Säure Base Titration
Bei der Säure-Base-Titration wird die Konzentration einer Säure oder Base in einer Probelösung bestimmt. Wie genau das funktioniert und wie die entsprechenden Titrationskurven aussehen, erfährst du im Artikel und im Video dazu!
Inhaltsübersicht
Säure Base Titration einfach erklärt
Die Säure-Base-Titration (Neutralisationstitration) ist ein Verfahren in der Chemie, das verwendet wird, um die Stoffmengenkonzentration c [mol/l] einer bekannten Säure oder Base in einer Probelösung zu bestimmen. Dabei wird sich zunutze gemacht, dass Säuren und Basen sich neutralisieren, wenn sie in einem bestimmten Mengenverhältnis vorkommen.
Kurz zusammengefasst sieht der Ablauf der Säure-Base-Titration folgendermaßen aus:
- Du hast eine dir bekannte Säure (oder Base), dessen Konzentration du aber nicht kennst. Sie ist nun deine Probelösung.
- Um ihre Konzentration herauszufinden, führst du die Titration durch: Dabei lässt du die sogenannte Maßlösung, also eine starke Base (bzw. Säure), kontinuierlich zu deiner Probelösung tropfen.
- Sie neutralisiert dort nach und nach die enthaltenen OH–-Ionen (bzw. H3O+-Ionen). Hat die Maßlösung die Probelösung dann vollständig neutralisiert, ist der sogenannte Äquivalenzpunkt erreicht.
- Mithilfe der Reaktionsgleichung und der Menge, der bis dahin hinzugefügten Maßlösung, kannst du dann die Konzentration der Probelösung berechnen.
Säure Base Titration Aufbau
Bei dem Säure-Base-Titrationsverfahren gibt es in der Regel folgenden Versuchsaufbau:
Dabei besteht der Aufbau im Allgemeinen aus vier Bestandteilen:
- Erlenmeyerkolben/Becherglas: In ihm befindet sich die zu analysierende Probelösung (z. B. HCl).
- Probelösung: Dabei handelt es sich um eine bekannte Säure, dessen Konzentration dir allerdings unbekannt ist. Es gibt auch Titrationen, bei denen die Probelösung eine Base ist.
- Bürette: Hier befindet sich deine Maßlösung (z. B. NaOH). An der Bürette ist außerdem eine Skala aufgetragen, die dir das Volumen anzeigt, das schon zur Probelösung hinzugegeben worden ist.
- Maßlösung: Dabei handelt es sich um eine starke Base, die meist in 1 Milliliter-Schritten zur Probelösung gegeben wird. Das Ziel ist die Neutralisation der Probelösung. Verwendest du als Probelösung eine Base, nimmst du als Maßlösung also eine Säure. Hierbei ist sehr wichtig, dass du dir merkst, welche Menge der Maßlösung du in die Probelösung gibst.
Säure Base Titration Arten
Bei der Titration unterscheidest du zwischen zwei Fällen:
- Acidimetrie: Die Probelösung ist eine Base und die Maßlösung eine Säure.
- Alkalimetrie: Die Probelösung ist eine Säure und die Maßlösung eine Base.
Je nachdem, um welche Art der Titration es sich handelt, neutralisiert also entweder eine Säure eine Base oder andersherum. Dabei findet folgende Neutralisationsreaktion statt:
H3O+ + OH– 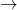 2 H2O
2 H2O
Hierbei sinkt oder steigt der pH-Wert der Probelösung, je nachdem, ob sie anfangs basisch (pH > 7) oder sauer (pH < 7) war.
Säure Base Titration Berechnung
Um die Konzentration der anfänglichen Probelösung, also der Säure oder Base vor der Titration, zu berechnen, gehst du Schritt für Schritt folgendermaßen vor:
1. Voraussetzung:
Ist der neutrale Punkt erreicht, kannst du annehmen, dass alle Oxonium-Ionen (H3O+) von der zugegebenen, basischen Maßlösung neutralisiert wurden. Das bedeutet, dass sozusagen die Säureteilchen Verbindungen eingehen und nicht mehr sauer sind. Der Äquivalenzpunkt ist also erreicht.
Aufgepasst: Bei einer Base als Probelösung sind hier entsprechend die Hydroxid-Ionen (OH–) von der sauren Maßlösung neutralisiert.
Daher muss am Äquivalenzpunkt die Stoffmenge der Säure der Stoffmenge der Base in der Probelösung entsprechen:
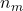 =
= 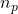
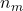 = Stoffmenge der hinzugefügten Maßlösung am Äquivalenzpunkt
= Stoffmenge der hinzugefügten Maßlösung am Äquivalenzpunkt
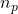 = Stoffmenge der Probelösung
= Stoffmenge der Probelösung
2. Errechnen der Stoffmengen:
Um die Stoffmenge der Maßlösung 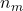 zu erhalten, benötigst du folgende Formel:
zu erhalten, benötigst du folgende Formel:
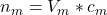
Da die Stoffmenge der hinzugefügten Maßlösung der Stoffmenge der Probelösung entspricht, kannst du mit der Formel also beide Stoffmengen berechnen.
3. Berechnen der Konzentration der Probelösung:
Neben den Stoffmengen sind dir auch das anfängliche Volumen der Probelösung 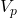 , das Volumen der hinzugefügten Maßlösung
, das Volumen der hinzugefügten Maßlösung 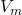 und die Konzentration der Maßlösung
und die Konzentration der Maßlösung 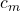 bekannt.
bekannt.
Setzt du alle Werte in die Formel ein, kannst du ganz einfach die Konzentration der Probelösung 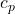 errechnen:
errechnen:
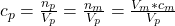
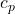 = Konzentration Probelösung
= Konzentration Probelösung
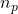 = Stoffmenge der Probelösung
= Stoffmenge der Probelösung
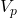 = anfängliches Volumen Probelösung
= anfängliches Volumen Probelösung
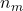 = Stoffmenge der Maßlösung am Äquivalenzpunkt
= Stoffmenge der Maßlösung am Äquivalenzpunkt
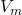 = Volumen Maßlösung
= Volumen Maßlösung
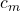 = Konzentration Maßlösung
= Konzentration Maßlösung
Wichtig: Damit du die Konzentration deiner ursprünglichen Probelösung berechnen kannst, musst du wissen, wann der Äquivalenzpunkt deiner Lösung erreicht ist. Denn du brauchst für die Formel das Volumen der Maßlösung, das du am Äquivalenzpunkt bereits hinzugefügt hast. Dafür kannst du entweder einen Farbindikator oder ein pH-Meter verwenden.
Wenn du dir einen Überblick verschaffen möchtest, welche Arten der Äquivalenzpunkt-Bestimmung es gibt, dann schau dir doch unser Video zum Äquivalenzpunkt an.
Äquivalenzpunkt der Titrationskurve
Der Äquivalenzpunkt bezeichnet den Endpunkt der Titration. Wenn du diesen erreicht hast, kannst du auf die Konzentration der Probelösung schließen. Jedoch liegt dieser Punkt nicht immer bei pH=7, wie man anfangs vielleicht annehmen könnte. Nur bei starken Basen oder Säuren, wie NaOH oder HCl, stimmt dieser Wert. Der Grund hierfür liegt in der Lage des chemischen Gleichgewichts der Säure-Base-Reaktion mit Wasser.
Schau dir dafür doch mal das Beispiel Essigsäure an:
Ac-H + H2O  Ac– + H3O+
Ac– + H3O+
Bei dieser Reaktion entsteht als Produkt ein Acetat-Ion, das selbst schwach basische Eigenschaften aufweist. Wenn du also den Äquivalenzpunkt erreicht hast, an dem alle Essigsäuremoleküle neutralisiert worden sind, liegt in der Lösung eine schwache Base vor. Es wird sich also nicht pH=7 einstellen, sondern ein leicht basischer Wert, im Fall von Essigsäure in etwa pH=8,2. Dies musst du berücksichtigen, wenn du den passenden Indikator für deine Titration auswählst.
Titrationskurve Verlauf
Die Titrationskurve zeigt die Veränderung des pH-Werts im Verlauf der Titration. Dabei werden die gemessenen pH-Werte gegen das Volumen der zugesetzten Maßlösung aufgetragen. Der Verlauf einer Titrationskurve unterscheidet sich dabei je nach Kombination aus starken oder schwachen Säuren und Basen.
Du unterscheidest dabei insgesamt drei verschiedene Verläufe von Titrationskurven, und zwar die von:
- starken Säuren mit starken Basen bzw. starken Basen mit starken Säuren
- schwachen Säuren mit starken Basen bzw. schwachen Basen mit starken Säuren
- mehrprotonigen Säuren mit starken Basen
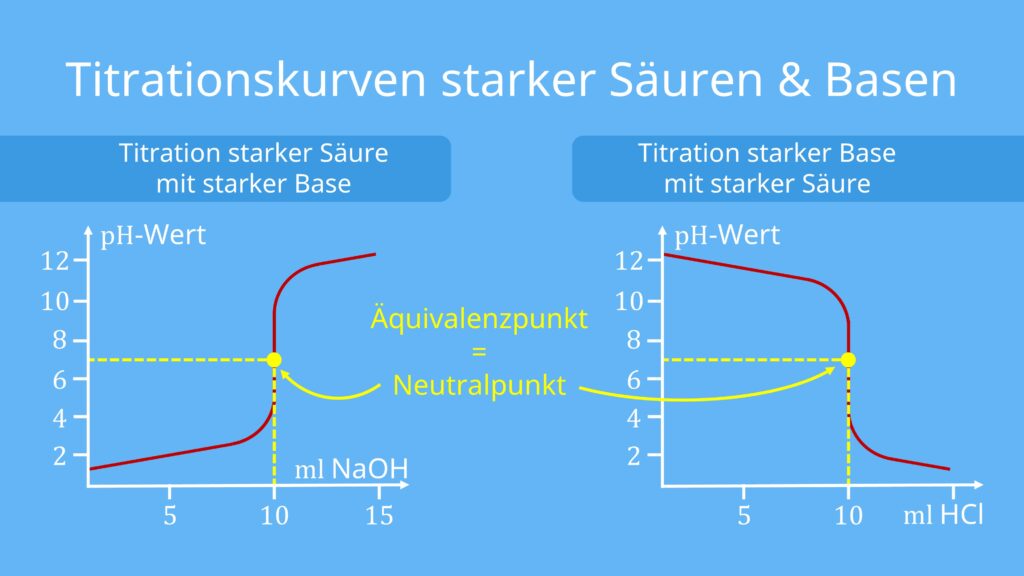
Titrationskurve starke Säure mit starker Base
Die Titrationskurve einer starken Säure mit einer starken Base ergibt sich bei der Titration von Salzsäure (HCl) und Natronlauge (NaOH). Der Äquivalenzpunkt liegt hier genau am Neutralpunkt, also bei pH=7. Um den Äquivalenzpunkt zu bestimmen, eignet sich beispielsweise der Indikator Bromthymolblau, da seine Farbe bei einem pH-Wert von etwa 6,0-7,6 umschlägt.
Titrierst du hingegen eine starke Base mit einer starken Säure, ist die Form der Kurve dieselbe, allerdings in entgegengesetzter Richtung. Das heißt, sie startet bei einem hohen pH-Wert und sinkt dann mit steigender Menge der hinzugefügten Säure zu einem sehr niedrigen pH-Wert.
Herleitung der Titrationsgleichung für starke Säuren
Schau dir das jetzt einmal an einem konkreten Beispiel an: Du titrierst eine HCl-Probelösung mit einer Maßlösung an NaOH. Bei starken Säuren und Basen kannst du annehmen, dass sie vollständig dissoziieren , also in Lösung gehen:
HCl + H2O  Cl– + H3O+
Cl– + H3O+
Merke: Die schwache Base der Salzsäure, das Cl–-Ion, beeinflusst den pH-Wert nicht mehr, da der pKb-Wert sehr hoch, die Base also sehr schwach, ist. Der Äquivalenzpunkt liegt deswegen ungefähr bei pH=7.
Das Reaktionsgleichgewicht liegt also auf der Produktseite, sodass in der Probelösung nur Oxonium-Ionen und Chlorid-Ionen vorliegen. Daher berechnet sich der anfängliche pH-Wert der Probelösung auch mit:
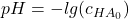
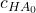 = anfängliche Säurekonzentration in der Probelösung
= anfängliche Säurekonzentration in der Probelösung
Willst du dir nochmal im Detail ansehen, wie du den pH-Wert einer Lösung berechnest, dann schau dir unser Video dazu an!
Durch diese Gleichung findest du also den Schnittpunkt der Titrationskurve mit der y-Achse heraus. Nun wird durch Zugabe der Maßlösung zur Probelösung der pH-Wert durch folgende Reaktion verändert:
H3O+ + OH– 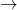 2 H2O
2 H2O
Der pH-Wert steigt also und muss nach folgender Gleichung verlaufen:
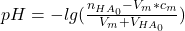
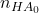 = gesamte in der Lösung vorhandene Stoffmenge der Säure
= gesamte in der Lösung vorhandene Stoffmenge der Säure
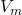 = Volumen der zugegebenen Maßlösung
= Volumen der zugegebenen Maßlösung
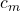 = Konzentration der zugegebenen Maßlösung
= Konzentration der zugegebenen Maßlösung
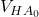 = anfängliches Volumen der Probelösung
= anfängliches Volumen der Probelösung
Wichtig: Du musst bei der Berechnung des pH-Werts unbedingt darauf achten, dass sich dein Gesamtvolumen verändert, da du ja eine Lösung hinzugibst.
Der steile Anstieg der Titrationskurve ergibt sich dadurch, dass sich bei Erreichen des Äquivalenzpunktes die Steigung der lg-Funktion stark vergrößert. Das liegt daran, dass Nenner und Zähler der Funktion aufgrund gleicher Stoffmengen gleich groß sind und den Wert 1 unterschreiten. Danach kommt es zum, für die lg-Funktion typischen, sehr starken Anstieg der Titrationskurve.
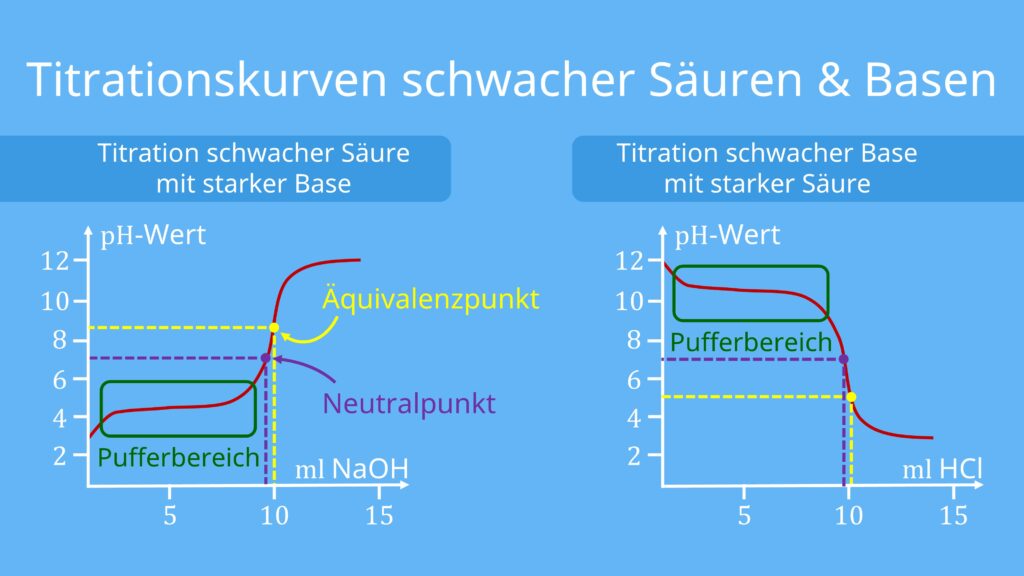
Titrationskurve schwache Säure mit starker Base
Bei der Titrationskurve einer schwachen Säure (z. B. Essigsäure) durch eine starke Base kannst du, wie bei starken Säuren, einen steilen Anstieg in der Mitte der Kurve sehen. Ihr Äquivalenzpunkt liegt allerdings über dem Neutralpunkt, also im basischen Bereich und auch der Start der Kurve beginnt weiter oben als bei stärkeren Säuren, da ihr pH-Wert geringer ist.
Auch bei der Titration einer schwachen Base mit einer starken Säure siehst du einen vergleichbaren Verlauf. Der ist allerdings umgekehrt: Es startet also mit einem hohen pH-Wert, gefolgt vom Pufferbereich, dem steilen Absinken des pH-Werts und schließlich einem konstant eingestellten niedrigen pH-Wert.
Erklärung für den Verlauf der Kurve (schwache Säure)
Die Titration einer schwachen Säure mit einer starken Base startet aufgrund des größeren pKs-Werts bei einem höheren pH-Wert. Das liegt daran, dass das chemische Gleichgewicht der Dissoziationsgleichung eher auf der Eduktseite liegt:
Ac-H + H2O 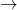 Ac– + H3O+
Ac– + H3O+
Die Neutralisationsgleichung bleibt dabei aber die Gleiche, es werden nach wie vor Oxonium-Ionen neutralisiert:
H3O+ + OH– 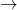 2 H2O
2 H2O
Wichtig ist hierbei: Mit fortlaufender Neutralisation wird das chemische Gleichgewicht der Dissoziationsreaktion, gemäß dem Prinzip von Le-Chatelier , immer weiter auf die Produktseite verschoben. Dadurch verändert sich die Konzentration der Oxonium-Ionen am Anfang nur kaum. Man spricht hier auch vom sogenannten Puffer-Bereich.
Herleitung der Titrationsgleichung für schwache Säuren
Schau dir dafür ein Beispiel an: Du titrierst eine Lösung an Essigsäure mit einer NaOH-Lösung. Den pH-Wert am Anfang kannst du dabei folgendermaßen ausrechnen:
pH = 0,5 (pKs-log(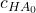 )
)
Diese Gleichung kannst du aus dem Massenwirkungsgesetz (MWG) herleiten, denn es definiert das chemische Gleichgewicht von chemischen Reaktionen. Für die Dissoziationsreaktion gilt dabei folgendes MWG:
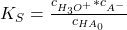
Hierbei nimmst du an, dass die Säure kaum dissoziiert, also die Gleichgewichtskonzentration von Essigsäure kaum von der Anfangskonzentration abweicht. Außerdem weißt du, dass aufgrund der Stöchiometrie die Konzentration des Acetats und der Oxonium-Ionen gleich groß sein muss:
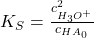
Nun musst du nur noch nach der Oxonium-Ionen Konzentration umstellen und den negativen, dekadischen Logarithmus davon nehmen und erhältst die obige Gleichung.
Henderson-Hasselbalch-Gleichung in der Titration schwacher Säuren
Für den weiteren Verlauf der Titrationskurve gilt diese obige, einfache Gleichung aber nicht mehr, dann musst du die Henderson-Hasselbalch Gleichung anwenden:
pH = pKs + log(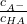 )
)
Achtung: Hier handelt es sich bei 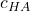 um eine sich ändernde Gleichgewichtskonzentration, nicht mehr um die Anfangskonzentration!
um eine sich ändernde Gleichgewichtskonzentration, nicht mehr um die Anfangskonzentration!
Es gibt bei der Titration von schwachen Basen und Säuren neben dem Äquivalenzpunkt auch noch einen weiteren charakteristischen Punkt: den Halbäquivalenzpunkt. Dieser tritt dann ein, wenn man so viel Maßlösung hinzugibt, dass genau die Hälfte der Säuremoleküle neutralisiert worden sind. Dann ist die Konzentration der Säuremoleküle und ihrer korrespondierenden Basemoleküle gleich groß:
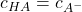
Diesen Zusammenhang kannst du dann in die Henderson-Hasselbalch-Gleichung einsetzen und erhältst:
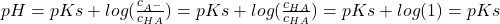
An diesem Punkt entspricht der pH-Wert auch dem pKs-Wert der Säure. Du findest ihn im flachen, unteren Verlauf der Titrationskurve. Er ist gleichzeitig auch der Punkt, in dessen Umgebung sich der pH-Wert am wenigsten durch Zugabe der Maßlösung ändert.
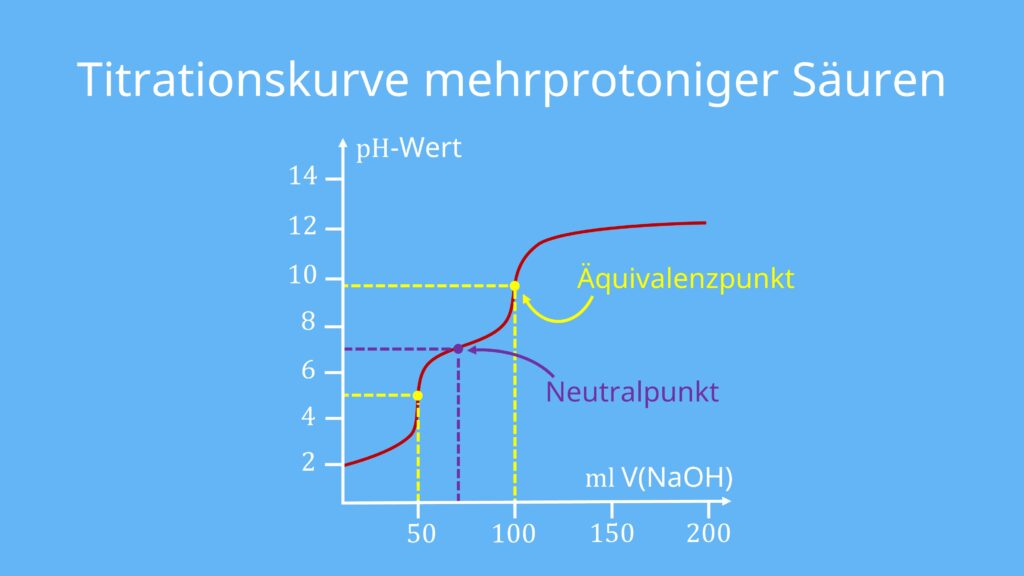
Titrationskurve mehrprotoniger Säuren
Die Titrationskurve mehrprotoniger Säuren, wie Schwefelsäure (H2SO4) oder Phosphorsäure (H3PO4), zeichnen sich dadurch aus, dass sie mehrere Äquivalenzpunkte haben. Das liegt daran, dass sie mehrere Protonen bei ihrer Dissoziation abgeben können.
Am Beispiel Schwefelsäure sähe das dann so aus:
H2SO4 + H2O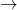 HSO4– + H3O+ ; pKs = -3
HSO4– + H3O+ ; pKs = -3
HSO4– + H2O 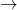 H3O+ + SO42- ; pKs = 1,9
H3O+ + SO42- ; pKs = 1,9
Wie du anhand der pKs-Werte erkennen kannst, kann man nur die erste Dissoziationsstufe als stark beschreiben. Der Schritt vom Hydrogensulfat (HSO4–) zum Sulfat-Ion (SO4–) ist hingegen eher eine mittelstarke, saure Dissoziation. Da es hier zwei Dissoziationsstufen gibt, kommt es logischerweise auch zu zwei Äquivalenzpunkten.
Merke: Bei mehrprotonigen Säuren ist es allerdings so, dass der 2. oder bei Phosphorsäure auch 3. Äquivalenzpunkt oftmals aus der gemessenen Titrationskurve nicht mehr bestimmbar ist. Das liegt daran, dass die pH-Sprünge um den Äquivalenzpunkt immer kleiner werden und so nicht mehr genau bestimmbar sind.
Titrationsarten
Neben der Säure-Base-Titration gibt es noch weitere, etwas speziellere Titrationsarten. Worum es sich bei der Konduktometrie und der Potentiometrie handelt und welche Chemikalien dabei titriert werden, erfährst du in unseren separaten Videos dazu!