Schwefel
Schwefel ist ein gelber Feststoff. Seine Eigenschaften und Verwendung erklären wir dir in diesem Beitrag. Hier geht’s direkt zum Video !
Inhaltsübersicht
Was ist Schwefel?
Schwefel (engl. sulfur) stammt vom Lateinischen sulpur, was soviel wie Salbe bedeutet. Das kommt vermutlich daher, dass das Element schon früher als Salbe gegen Hautkrankheiten verwendet wurde.
Im Periodensystem findest du Schwefel unter dem Symbol S. Er kommt auf unserer Erde im Boden, Wasser, Luft und Lebewesen vor.
Die Besonderheit bei Schwefel ist, dass es verschiedene Modifikationen (z.B. α-Schwefel, β-Schwefel) bildet. Darunter verstehst du unterschiedliche Strukturformen.
Schwefel Steckbrief
Im Folgenden Steckbrief haben wir dir einige physikalische und chemische Eigenschaften des Elements Schwefel zusammengestellt:
| Steckbrief Schwefel | |
| Zeichen / Symbol im Periodensystem | S |
| Hauptgruppe | 6 |
| Periode | 3 |
| Ordnungszahl | 16 |
| Elementkategorie | Nichtmetalle |
| Molare Masse | 32,06 u |
| Vorkommen in der Natur |
|
| Besonderheiten | kann homoatomare (aus demselben Element bestehend) ketten- und ringförmige Moleküle ausbilden |
| Isotope | 23 Stück: von 26S bis 49S; davon vier stabile: 32S, 33S, 34S und 36S |
| Aussehen | unter Normalbedingungen: gelber Feststoff |
| Geruch | geruchlos; in Kombination mit Wasserstoff riecht er nach faulen Eiern |
| Löslichkeit | nahezu unlöslich in Wasser, bedingt löslich in Alkoholen wie Ethanol (C2H5OH) |
| Schmelzpunkt | 115,21°C |
| Siedepunkt | 445°C |
| Dichte | 2,07 g/cm3 |
| Elektronegativität | 2,58 (Pauling-Skala) |
| Elektronenkonfiguration | [Ne] 3s2 3p4 |
| Oxidationszahlen | -2, -1, 0, +1, +2, +3, +4, +5, +6 |
Schwefel Eigenschaften
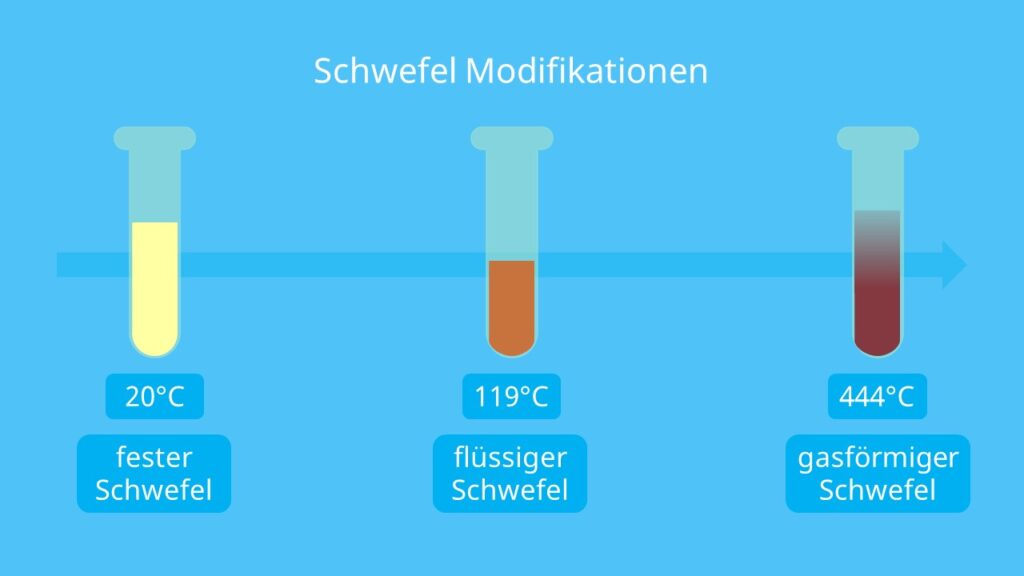
Eine Besonderheit des Elements ist es, dass es in vielen verschiedenen Modifikationen (Erscheinungsformen) auftritt. Sie sind von der Temperatur abhängig.
Fester Schwefel
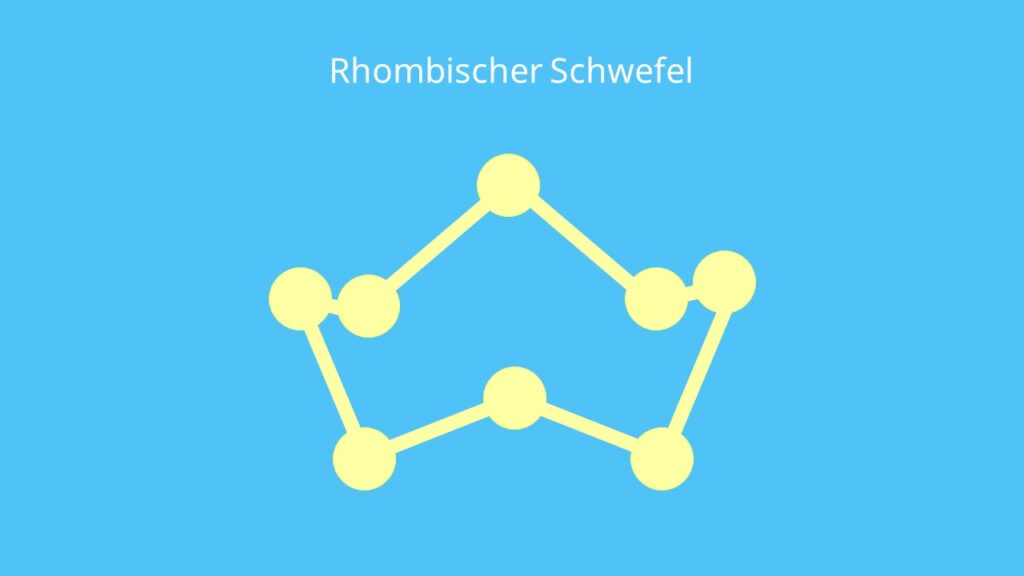
Die stabilste Erscheinungsform ist dabei der rhombische Schwefel, den du auch α-Schwefel nennst. Er ist aus ringförmig gewellten S8-Molekülen aufgebaut.
In der Natur tritt der rhombische Schwefel als Schwefelblüte auf. Darunter kannst du dir gelbe Kristalle vorstellen, die sich auf Gesteinsflächen bilden. Die Erscheinungsform des Schwefels hat eine niedrige Viskosität (Zähflüssigkeit).
Erwärmst du die Modifikation auf 95,6°C, erhältst du den β-Schwefel. Du bezeichnest ihn auch als monoklinen Schwefel. Die Erscheinungsform ist – im Gegensatz zur rhombischen Modifikation – farblos. Aber auch hier handelt es sich um Kristalle.
Flüssiger Schwefel
Ab einer Temperatur von 119,6°C schmilzt der β-Schwefel und γ-Schwefel wird gebildet. Das ist eine gelbe, leichtflüssige Schmelze. Auf molekularer Ebene kannst du dir den Übergang von fest in flüssig so erklären, dass die Ringe aufgebrochen werden. Dadurch entstehen Schwefelketten. Schreckst du die Flüssigkeit in kaltem Wasser ab, erhältst du plastischen Schwefel. Darunter kannst du dir eine gelbbraune, zähe Masse vorstellen.
Gasförmiger Schwefel
Neben festem und flüssigem Schwefel, existiert das Element auch noch in gasförmiger Form. Er ist dunkelrot und besteht zunächst aus S8-Molekülen. Erhöhst du allerdings die Temperatur auf 550°C, zerfallen die Ringe in S4-Ringe oder kommen als S2 -Molekül vor. Ab 1800°C liegen nur noch Schwefelatome vor.
Schwefel Reaktionen
Das Element ist sehr reaktionsfähig und geht daher mit vielen Elementen eine chemische Verbindung ein. Dazu gehört auch Sauerstoff . An der Luft verbrennt Schwefel nämlich in einer Redoxreaktion zum giftigen Gas Schwefeldioxid (SO2):
![Rendered by QuickLaTeX.com \[\ce{S + O2 -> SO2 }\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-ce097b6a2b0d2590047973c3be8ac322_l3.png)
Dabei kannst du eine blaue Flamme beobachten.
Mit Metallen wie beispielsweise Zink (Zn) reagiert Schwefel sehr heftig. Bei der Reaktion entsteht unter Wärmeentwicklung und Aufleuchten Zinksulfid (ZnS):
![Rendered by QuickLaTeX.com \[\ce{Zn + S -> ZnS }\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-313a76e20ed2ca7a0ec3c6bb6e516224_l3.png)
Auch Eisen und Schwefel bilden zusammen ein Metallsulfid, das du Eisensulfid (FeS) nennst:
![Rendered by QuickLaTeX.com \[\ce{Fe + S -> FeS }\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-7bafc251dd0168552e918ae9a3114508_l3.png)
Bei einer Reaktion von Schwefel mit dem Alkalimetall Lithium erhältst du Lithiumsulfid (Li2S):
![Rendered by QuickLaTeX.com \[\ce{2 Li + S -> Li2S }\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-d5835afef124ad1fff515fe780390bf8_l3.png)
Das Produkt spielt eine wichtige Rolle bei der Entwicklung von Lithium-Schwefel-Akkus.
Mit dem chemischen Element Wasserstoff (H) kann der gelbe Feststoff ebenfalls eine Reaktion eingehen. Hier erhältst du dann Schwefelwasserstoff (H2S):
![Rendered by QuickLaTeX.com \[\ce{S + H2 -> H2S }\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-5f432d576aacadd046ca9b8beb56bcc7_l3.png)
Schwefelwasserstoff kann aber auch dann entstehen, wenn du das Element S mit Methan (CH4) zur Reaktion bringst:
![Rendered by QuickLaTeX.com \[\ce{CH4 + 4 S -> CS2 + 2 H2S}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-ec94912db9c911156c599a35c96b02f5_l3.png)
Neben H2S wird hier aber auch noch die giftige Flüssigkeit Schwefelkohlenstoff (CS2) produziert.
Schwefel Giftigkeit
Elementarer Schwefel hat eine geringe Toxizität. Allerdings kann er in gasförmiger Form deine Haut und Augen reizen. Außerdem entsteht bei der Verbrennung von Schwefel das giftige Gas Schwefeldioxid (SO2).
Als Bioelement ist Schwefel für den menschlichen Körper wichtig. Denn er ist in Aminosäuren wie beispielsweise Cystin, Cystein und Methionin enthalten. Cystein kommt beispielsweise in deinen Haaren vor. Schwefel liegt in den Aminosäuren in Form von Thiolgruppen (R-S-H) vor.
Auch Pflanzen benötigen den gelben Feststoff. Sie nehmen ihn als Sulfate (SO42-) über die Wurzeln auf. Die Sulfate werden dann in den Chloroplasten zu den Aminosäuren Cystein und Methionin umgewandelt.
Schwefel Vorkommen
Der gelbe Feststoff kommt elementar in der Natur vor. Dabei kannst du zwischen vulkanischen Ursprungs oder Ablagerungen unterscheiden. Vulkanischen Ursprungs sind beispielsweise Lagerstätten in Sizilien, Japan und Chile. An Orten wie Polen, Texas, Kanada und dem Irak hat sich der elementare Schwefel durch Ablagerung gebildet.
An Vulkanen kommen sogenannte Fumarolen (vulkanische Dampfaustrittsstätten) vor. Sie stoßen neben Schwefelwasserstoff (H2S) auch elementaren Schwefel aus. Der elementare Schwefel kondensiert dann an der Austrittsstelle und bildet Kristalle. Das ist beispielsweise auf Island der Fall. Im Mittelalter wurden die Kristalle verwendet, um Schwarzpulver (Schießpulver) herzustellen.
Aber auch in einigen Mineralien ist der gelbe Feststoff enthalten. Beispiele dafür sind Gips (Calciumsulfat CaSO4), Pyrit und Markasit (Eisen(II)-disulfid FeS2), Bleiglanz (Bleisulfid PbS) und Zinkblende (Zinksulfid ZnS).
Größere Mengen an Schwefel findest du auch in den fossilen Brennstoffen Erdöl und Kohle.
Schwefel Verwendung
Schwefel wird sowohl in der chemischen als auch in der pharmazeutischen Industrie vielseitig eingesetzt. Schauen wir uns am besten ein paar Beispiele an:
-
Synthesestoff: Das Element ist bei der Herstellung einiger (chemischer) Stoffe beteiligt:
- Ein Großteil des Schwefels dient zur Herstellung der Schwefelsäure (H2SO4) mithilfe eines Katalysators (Reaktionsbeschleunigers). Ungefähr 60 % der Schwefelsäure werden zur Produktion von Düngemitteln genutzt.
- Reiner Schwefel wird zur Synthese von Zündhölzern, Schwarzpulver, Feuerwerkskörpern, Kunststoffen, Farbstoffen oder Pigmenten verwendet.
- Katalysatorgift: Einige Katalysatoren (z.B. Platin-Rhenium-Katalysatoren) werden mit dem Element beaufschlagt, um deren Aktivität zu verringern.
- Vulkanisation von Kautschuk: Hier wird das Elastomer Rohkautschuk mit reinem Schwefel oder schwefelhaltigen Verbindungen versetzt. Dadurch bilden sich zwischen Kautschuk-Molekülen Sulfidbrücken (Bindung zwischen zwei Schwefelatomen) aus. So wird der Kautschuk widerstandsfähiger.
- Medizin: In dem Bereich wird der Schwefel in Form von Cremes, Salben oder Seifen eingesetzt. Sie dienen zur Bekämpfung von Hautkrankheiten wie Akne, Ekzeme, Krätze oder Schuppenflechte. Schwefelbäder sollen sogar gegen Rheuma und Gicht helfen.
- Wein- und Gartenbau: Du kannst das Element gegen Spinnmilben und Mehltau einsetzen.
- Lebensmittelindustrie: Beim sogenannten „schwefeln“ werden Lebensmittel wie Wein oder Trockenobst konserviert, also länger haltbar gemacht.
- Stahlindustrie: Der gelbe Feststoff hat hier die Aufgabe als Legierungselement. Durch die Legierung können bestimmte Eigenschaften von Stahl optimiert werden.
Schwefel Herstellung
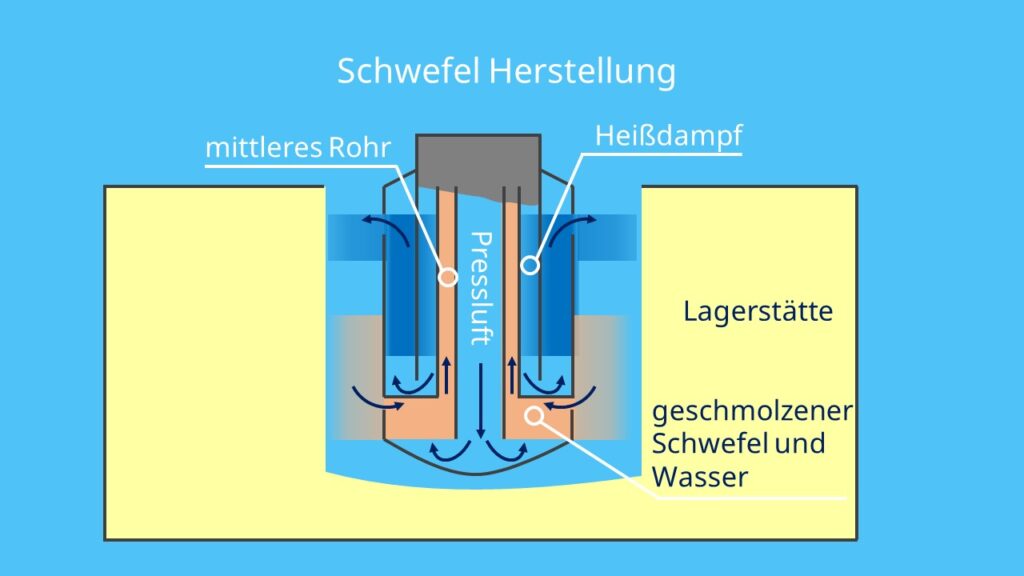
Da das Element so häufig in der Natur vorkommt, wird ungefähr die Hälfte des benötigten Schwefels daraus gewonnen. Dafür muss der Schwefel gereinigt und anschließend destilliert werden. Das funktioniert, indem durch ein sehr langes Rohr heißes Wasser in das schwefelhaltige Gestein gedrückt wird. Dadurch schmilzt das Element und kann anschließend mit heißer Pressluft nach oben befördert werden. Durch das Verfahren können bis zu 300 Tonnen Schwefel am Tag gewonnen werden!
Du erhältst auch große Mengen des chemischen Elements S durch das sogenannte Claus-Verfahren. Darunter verstehst du einen Prozess, bei dem Schwefelwasserstoff (H2S) in mehreren Schritten zu flüssigem Schwefel oxidiert wird.
Schritt 1:
![Rendered by QuickLaTeX.com \[\ce{2 H2S + 3 O2 -> 2 SO2 + 2 H2O}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-a89a6b5896b38dc24db29e5b7bbc558a_l3.png)
Hier entstehen also Wasser (H2O) und Schwefeldioxid (SO2). Im zweiten Schritt reagiert dann Schwefelwasserstoff (H2S) mit dem Schwefeldioxid zu Schwefel (S2).
Schritt 2:
![Rendered by QuickLaTeX.com \[\ce{2 H2S + SO2 -> 3/2 S2 + 2 H2O}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-a1d3e85e12119afd853c4b7bd6f2e87b_l3.png)
Eine dritte Möglichkeit, den gelben Feststoff zu erhalten, ist das Erhitzen des Minerals Pyrit (Eisen(II)-disulfid FeS2). Wenn du es anschließend mit Kohlenstoff reduzierst, erhältst du Schwefel.
Schwefel Verbindungen
Grundsätzlich kannst du zwischen organischen und anorganischen Schwefelverbindungen unterscheiden. Schauen wir uns für beide ein paar Beispiele an:
Organische Schwefelverbindungen
- Aminosäuren: Einige essentielle Aminosäuren wie Methionin enthalten das chemische Element S.
- Thiole: Sie erkennst du an der Gruppe R-S-H. Beispiele für Thiole sind Cystein oder auch das Coenzym A.
Anorganische Schwefelverbindungen
- Sauerstoffsäuren: Das sind Verbindungen von Schwefel mit den Elementen Wasserstoff und Sauerstoff. Dazu zählst du beispielsweise die dithionige Säure (H2S2O4), die Dischwefelsäure (H2S2O7) und Schwefelsäure (H2SO4).
- Oxide: Der gelbe Feststoff kann mit Sauerstoff nicht nur Säuren bilden, sondern auch Oxide wie Schwefeldioxid (SO2) oder Schwefeltrioxid (SO3).
- Stickstoffverbindungen: Hierzu kannst du Verbindungen wie Tetraschwefeltetranitrid (S4N4) oder Dischwefeldinitrid (S2N2) zählen. Sie dienen zur Herstellung von weiteren Schwefel-Stickstoff-Verbindungen.
Welche Verbindungen Stickstoff noch eingehen kann und welche Besonderheit das Element mit sich bringt, erfährst du in unserem Video dazu!