Stoffmengenkonzentration
Du möchtest wissen, was die Stoffmengenkonzentration (Molarität) ist und wie du sie berechnest? Genau das erfährst du in unserem Video und Beitrag!
Wenn du zur Stoffmengenkonzentration weitere Übungen machen möchtest, dann schau dir unsere Videos mit einer Übungsaufgabe und Klausuraufgabe an!
Inhaltsübersicht
Stoffmengenkonzentration einfach erklärt
Die Stoffmengenkonzentration (früher Molarität) beschreibt die Zusammensetzung einer Mischung. In der Mischung ist ein Stoff (z.B. Salz) in einem Volumen aufgelöst (z.B. Wasser). Dabei betrachtest du nicht das Gewicht deines Stoffes, sondern seine Stoffmenge.
Die Molarität c gibt dir also zum Beispiel an, wie viel Mol Salz (NaCl) du in 3 l einer Kochsalzlösung hast (Mischung aus Salz und Wasser). Deswegen benutzt du die Einheit mol/L und die Formel:
![Rendered by QuickLaTeX.com \[c = \frac{n}{V}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-98e7e08444b73ac48d5dc7b4176ae6f3_l3.png)
- c = Stoffmengenkonzentration
- n = Stoffmenge
- V = Volumen
Die Stoffmengenkonzentration, auch Molarität, ist die Konzentration eines gelösten Stoffes in einer Flüssigkeit oder Gas. Sie trägt das Formelzeichen c und ist definiert als Stoffmenge n geteilt durch Volumen V, wodurch sich die Einheit [mol/L] ergibt.
Stoffmengenkonzentration berechnen
Für die Berechnung der Stoffmengenkonzentration benötigst du die Stoffmenge . Wie der Name schon sagt, gibt dir die Stoffmenge die Menge eines Stoffes an. Dabei ist sie nicht als Anzahl der Teilchen oder Masse festgelegt, sondern definiert durch die Teilchenanzahl in einem Mol.
Mol gibt dir sozusagen die „Verpackungsgröße“ für eine bestimmte Anzahl an Teilchen an. Die Anzahl der Teilchen pro Mol ist für jeden Stoff gleich, nämlich 6,02 • 1023. Die Teilchenzahl 6,02 • 1023entspricht der sogenannten Avogadrokonstante .
Stoffmengenkonzentration berechnen – Beispiel
Im Folgenden siehst du eine Beispielaufgabe zur Stoffmengenkonzentration. Falls du detaillierte Aufgaben zur Konzentration haben möchtest, haben wir dir am Ende des Artikels Klausur- und Übungsaufgaben verlinkt.
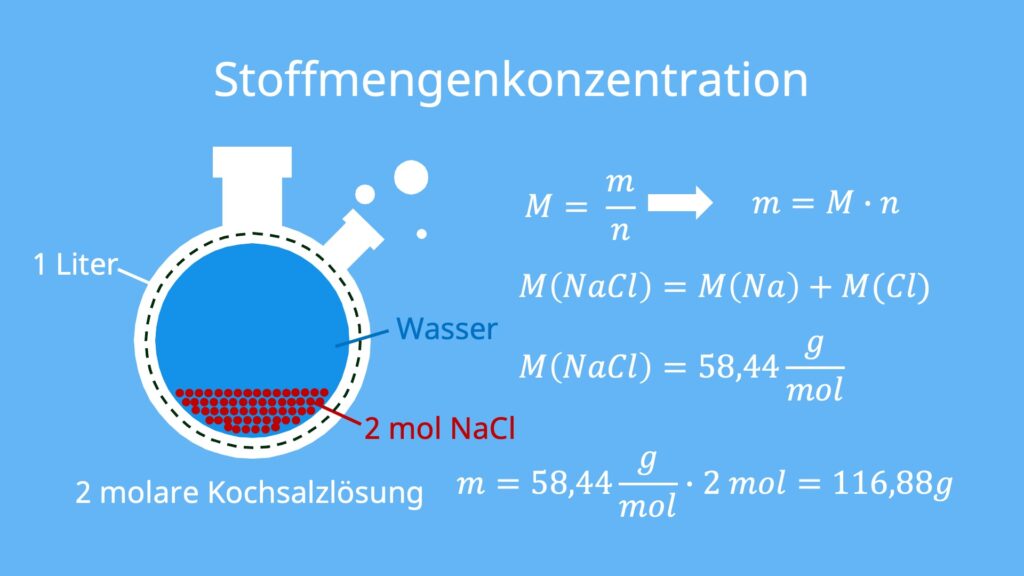
Eine 2 molare Kochsalzlösung bezeichnet einen 1 Liter-Behälter in dem sich Wasser und 2 mol Natriumchlorid befinden. Doch wie viel Kochsalz brauchst du, um eine 2 molare Kochsalzlösung zu erzeugen?
Dafür benutzt du die folgende Formel:
![Rendered by QuickLaTeX.com \[M = \frac{m}{n}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-306ca5b47b3c722d9377a5f30502a098_l3.png)
Du suchst die Masse m und kennst sowohl die Stoffmenge n als auch die molare Masse M.
Denn die molare Masse M kannst du über die chemische Zusammensetzung von Natriumchlorid ausrechnen. Es besteht aus einem Natriumatom und einem Chloratom. Die molare Masse M von NaCl ist also die Summe der molaren Massen eines Natriumatoms und eines Chloratoms. Die jeweiligen molaren Massen kannst du ganz einfach im Periodensystem ablesen. Die molare Masse M ergibt sich somit aus:
![Rendered by QuickLaTeX.com \[M_{\text{NaCl}} = M_{\text{Na}} + M_{\text{Cl}} =\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-e8526138fada8df1f9cb8ab99ff770da_l3.png)
![Rendered by QuickLaTeX.com \[22,99 \frac{\text{g}}{\text{mol}} + 35,45 \frac{\text{g}}{\text{mol}} = 58,44 \frac{\text{g}}{\text{mol}}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-f20741d506570743c0d2b7139ceac103_l3.png)
Stell nun die Formel nach m um und setze deine Werte ein. Du erhältst einen Wert von 116,88g Kochsalz, um eine 2 molare Kochsalzlösung mit einem Volumen von einem Liter zu erzeugen.
Zusätzlich kannst du nun die Stoffmengenkonzentration von NaCl berechnen. Sie ist:
![Rendered by QuickLaTeX.com \[c_{\text{NaCl}} = \frac{2 \text{mol}}{1\text{l}} = 2\frac{\text{mol}}{\text{l}}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-ded93c79c0487ab87acd527cf486e91d_l3.png)
Mischungskreuz
Eine weitere Aufgabenstellung könnte sein, dass dir eine Lösung gegeben wird und du durch Verdünnung eine andere Konzentration erreichen sollst. Dabei hilft dir das sogenannte Mischungskreuz. Schauen wir uns ein Beispiel an.
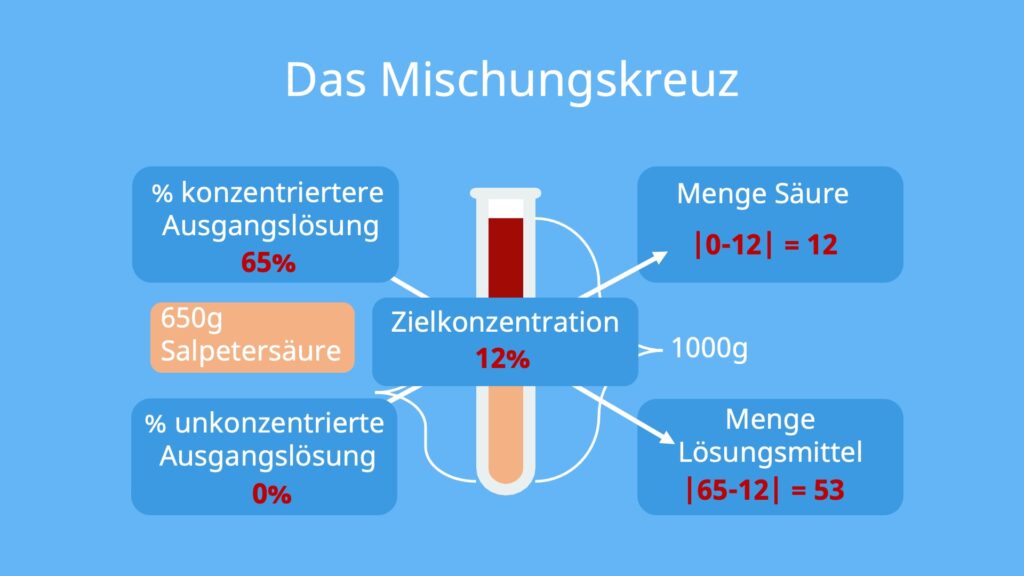
Die Aufgabe lautet: Durch Verdünnen soll aus einer 65%igen Salpetersäure eine 12%ige Salpetersäure hergestellt werden. Hier sind die Konzentrationen nicht in mol pro Liter, sondern in Massenprozent angegeben. Das bedeutet, dass in einem Kilogramm unserer Ausgangslösung 650g reine Salpetersäure enthalten sind.
Das Mischungskreuz kannst du dir ganz einfach aufzeichnen, indem du oben links die Massenprozent der stärker konzentrierten Ausgangslösung – in unserem Fall die 65%ige Salpetersäure – einzeichnest. Unten links kommt die Anfangskonzentration der schwächer konzentrierten Lösung hin. Also destilliertes Wasser, da wir das zum Verdünnen verwenden. Es hat den Massenprozentanteil von 0%, da keine Salpetersäure in dem Wasser gelöst ist. In die Mitte kommt die Konzentration, die unsere Lösung am Ende haben soll. Oben rechts steht dann die Menge an Salpetersäure und unten rechts die Menge an Wasser, die wir brauchen, um unsere Ziel-Konzentration zu erreichen.
Jetzt kannst du die rechten Seiten ausrechnen. Du kannst entlang der Pfeile rechnen, solange du die Rechnungen als Betrag annimmst. Für die Menge an Salpetersäure gilt also:
![Rendered by QuickLaTeX.com \[| 0 - 12 | = 12\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-9e7ca5cf7fc5dd64ac19615b8233c23b_l3.png)
![Rendered by QuickLaTeX.com \[|65 - 12| = 53\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-51cac7bfa50a9bbd777643f470d9b007_l3.png)
Das bedeutet, dass wir 12g 65%ige Salpetersäure in 53g destilliertem Wasser lösen müssten, um eine 12%ige Salpetersäure zu erhalten.
Stoffmengen und Konzentrationen Übungsaufgabe
Um die wichtigsten Grundlagengleichungen in der Chemie zu üben, haben wir für dich hier eine Übungsaufgabe zusammengestellt.
Du möchtest 350 ml einer Kochsalzlösung herstellen, die eine Stoffmengenkonzentration von 2,86 mol/l aufweist. Wie viel Gramm Natriumchlorid musst du dafür abwiegen und zur gewünschten Menge mit Wasser auflösen?
Die Lösung zu dieser Aufgabe mit einem verständlichen Rechenweg erfährst du in unserem Übungsvideo .
Stoffmengen und Konzentrationen Klausuraufgabe
Um dich für deine nächste Prüfung vorzubereiten, schauen wir uns nun eine beispielhafte Klausuraufgabe an.
Im Biologieunterricht hast du erfahren, dass die Schale eines gewöhnlichen Hühnereis auch aus Kalk, also CaCO3, besteht. Allerdings weißt du nicht, welchen Massenanteil das Kalziumkarbonat an der gesamten Hülle ausmacht. Daher entscheidest du dich kurzerhand, das selbst herauszufinden.
Du nimmst ein paar Eierschalenreste und mahlst sie zu einem feinen Pulver. Mit einer Waage erfährst du, dass deine Probe 15 Gramm wiegt. Anschließend übergießt du dieses mit einem Liter zwei molarer Salzsäure. Du siehst, wie Luftblasen aus deiner Lösung aufsteigen, was auf eine Gasentwicklung hindeutet. Danach wartest du ab, bis dieser Prozess abgeschlossen ist.
Aus dem Chemieunterricht weißt du, dass man die Stoffmenge der noch vorhandenen Salzsäure durch Titration mit einer Base bestimmen kann. Dafür gibst du eine 0,2 molare Natronlauge in die Lösung. Bis zum Erreichen des Äquivalenzpunktes verbrauchst du hierfür insgesamt 1,2 Liter.
Nun sollst du den Masseanteil an Kalziumkarbonat in deiner Eierschalenprobe berechnen.
Überlege hierfür zunächst, welche Schritte nacheinander durchgeführt werden, und was die Ergebnisse dieser sind. Das Aufstellen der relevanten Reaktionsgleichungen kann dir hierbei helfen.
In unserem Video zur Klausuraufgabe erklären wir dir Schritt für Schritt, wie du diese Aufgabe bearbeiten kannst.
![Rendered by QuickLaTeX.com \[c_\text{i} = \frac{n_\text{i}}{V}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-d36d28053b96822d8514a8df25853426_l3.png)
![Rendered by QuickLaTeX.com \[[c_\text{i}] = 1 \frac{\text{mol}}{\text{l}}\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-8b6170ffa3a1bfb17c2e6465cf1e5961_l3.png)