Gemische – Grundlagen
Du weißt sicher, dass Luft nicht nur aus Sauerstoff, sondern auch aus Stickstoff und vielen anderen Gasen besteht. Sie ist also ein Gasgemisch. Was es bei Gemischen zu beachten gibt, zeigen wir dir in diesem Beitrag.
Inhaltsübersicht
Materie und Massenanteil
Bisher haben wir nur EINEN Stoff betrachtet. Bei Gemischen müssen wir hingegen mehrere Stoffe berücksichtigen. Um die Stoffe dann zu unterschieden, verwenden wir Indizes. Diese werden uns dabei helfen, die verschiedenen Zustandsgrößen von Gemischen zu betrachten.
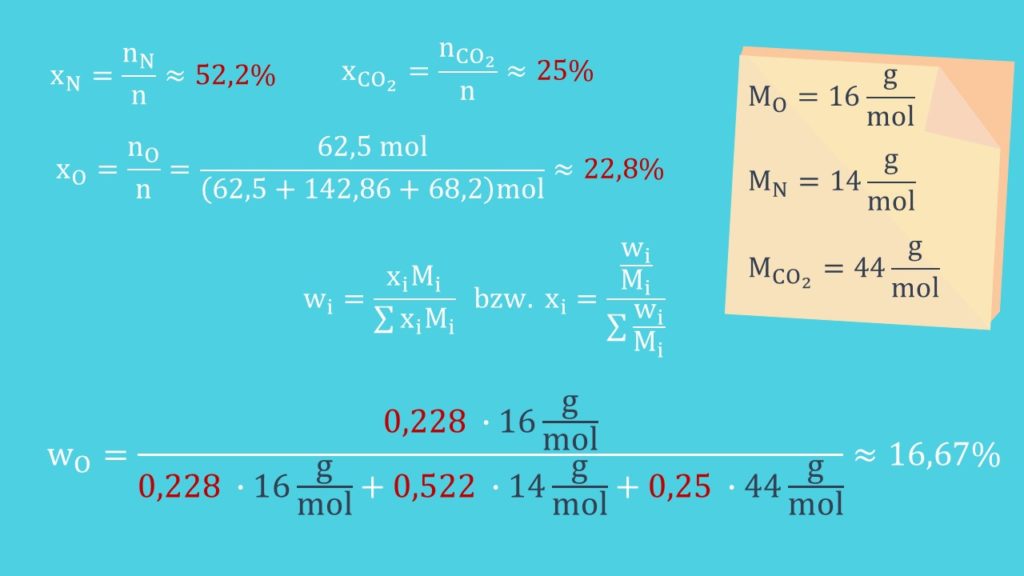
Zunächst beschäftigen wir uns mit der Materie. Dafür schauen wir uns ein Gemisch aus einem Kilogramm Sauerstoff, zwei Kilogramm Stickstoff und drei Kilogramm CO zwei an. Die Gesamtmasse m ist dann sechs Kilogramm. Wir können uns jetzt den Massenanteil einer Komponente bestimmen. Also wie viel eine Komponente vom gesamten Gemisch ausmacht. Wir definieren den Massenanteil als:
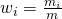
Sauerstoff
Für Sauerstoff erhalten wir zum Beispiel:
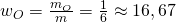
Stoffmenge
Für die Stoffmenge können wir das analog machen. Diese können wir aus der Masse und der Molaren Masse bestimmen. Die Molaren Massen findest du im Periodensystem der Elemente. Zur Vereinfachung rechnen wir im weiteren Verlauf mit gerundeten Werten. Für unser Gemisch erhalten wir:
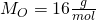
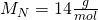
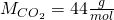
Die Molare Masse von CO zwei setzt sich dabei aus der Molaren Masse des Kohlenstoffs und zwei Mal der Molaren Masse des Sauerstoffes zusammen. Die Stoffmenge lässt sich nun berechnen mit:
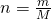
Die Stoffmengen ergeben sich also zu:
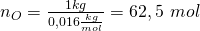
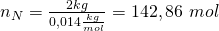
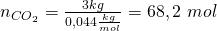
Stoffmengenanteil
Jetzt können wir den Stoffmengenanteil bestimmen mit:
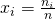
Für Sauerstoff erhalten wir dann einen Stoffmengenanteil von:
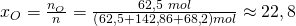
Analog erhalten wir für die anderen beiden Stoffe:
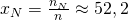
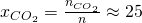
Die beiden Verhältnisse lassen sich nun auch ineinander umrechnen:

Wie du siehst, benötigst du dafür lediglich die Molaren Massen.
Zur Kontrolle setzen wir die Werte unseres Beispiels ein und erhalten:
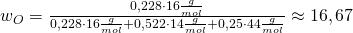
Du siehst, es kommt für den Massenanteil genau der zuvor ermittelte Wert heraus. Damit haben wir die Aufgabe gelöst!
So, mit diesem Wissen kannst du dir ganz einfach bestimmen, wie viel Sauerstoff in einem Kubikmeter Luft ist. Viel Spaß dabei!