Elektrolyse
Die Elektrolyse ist in der Chemie ein häufig verwendetes Verfahren. Was eine Elektrolyse ist und wo du sie in der Chemie findest, erklären wir dir hier und im Video .
Inhaltsübersicht
Was ist eine Elektrolyse?
Eine Elektrolyse ist ein Verfahren, bei dem durch elektrischen Strom eine Redoxreaktion erzwungen wird. Dabei wird elektrische Energie in chemische Energie umgewandelt. Beispielsweise wird die Elektrolysezelle zur Herstellung und Aufreinigung von Stoffen verwendet.
Die Elektrolyse findet in einer Elektrolysezelle statt. Sie ist das Gegenteil der galvanischen Zelle. Am besten erkennst du das am Beispiel eines Akkus: Der Ladeprozess ist die Elektrolyse, der Entladeprozess die galvanische Reaktion.
Die Elektrolyse ist eine Redoxreaktion, welche durch elektrische Energie erzwungen wird. Die elektrische Energie wird dabei in chemische Energie umgewandelt.
Elektrolysen haben in der Chemie vielfältige Anwendungsbereiche: Beispielsweise bei der Gewinnung von Metallen (Aluminium) oder der Spaltung von Wasser in Wasserstoff und Sauerstoff.
Aufbau Elektrolysezelle
Eine Elektrolysezelle besteht aus zwei Elektroden, an denen die Teilreaktionen der Redoxreaktion ablaufen. Die Elektroden sind über eine Spannungsquelle verbunden und befinden sich in einer leitfähigen Flüssigkeit. Die leitfähige Flüssigkeit bezeichnest du auch als Elektrolyten. Er besteht aus Kationen und Anionen.
Die mit dem Minuspol verbundene Elektrode nennst du Kathode, die mit dem Pluspol verbundene Elektrode heißt Anode.
Demnach sind der Aufbau von Elektrolysezelle und galvanischer Zelle sehr ähnlich. Es gibt aber zwei grundlegende Unterschiede:
- die Elektrolysezelle verwendet eine Spannungsquelle, die galvanische Zelle einen Stromabnehmer
- eine Elektrolyse findet in einem Behälter statt, die galvanische Zelle ist zweigeteilt
Prinzip Elektrolyse
Eine Elektrolyse läuft folgendermaßen ab: Wenn du über die beiden Elektroden einen Gleichstrom anlegst, fließen die Elektronen in Richtung der Kathode. Somit entsteht an der Anode ein Elektronenmangel und an der Kathode ein Elektronenüberschuss.
Der Elektronenüberschuss an der Kathode führt dazu, dass die positiven Kationen sich zur Kathode bewegen. Dort nehmen sie die überschüssigen Elektronen auf und werden somit reduziert. Die gleiche Anzahl an negativen Anionen wandert währenddessen zur positiven Anode und gibt dort ihre Elektronen ab (Oxidation).
Für den Ablauf einer Elektrolyse ist eine Mindestspannung erforderlich. Du nennst sie auch Zersetzungsspannung ( ). Erst wenn deine Zersetzungsspannung erreicht ist, läuft die Elektrolyse ab.
). Erst wenn deine Zersetzungsspannung erreicht ist, läuft die Elektrolyse ab.
Elektrolyse Beispiele
Es gibt sehr viele Beispiele für Elektrolysen. Damit du das Prinzip der Elektrolyse besser verstehst, zeigen wir dir einige. Die Elektrolysen von…
- Zinkiodid (ZnI2)
- Natriumchlorid (NaCl) und
- Wasser
Elektrolyse Zinkiodid
Zinkiodid (ZnI2) ist eine chemische Verbindung aus Zink und Iod und zählt zu den Halogeniden. Du kannst eine wässrige Lösung von Zinkiodid als Elektrolyten verwenden.
Wenn du nun eine Gleichspannung anlegst, wandern die positiv geladenen Zinkionen (Zn2+) zur Kathode. Dort nehmen sie zwei Elektronen auf (Reduktion) und an der Kathode bildet sich elementares Zink (Zn). Eine Rückreaktion des elementaren Zinks verhinderst du durch eine gleichmäßige Zersetzungsspannung und somit einen konstanten Elektronenüberschuss an der Kathode.
Die negativ geladenen Iodidionen (2I–) sammeln sich an der Anode. Dort geben sie jeweils ein Elektron ab (Oxidation). Dabei entsteht elementares Iod (I2).
Oxidation: 2 I– -> I2 + 2e–
Reduktion: Zn2+ + 2e– -> Zn
Die gesamte Redoxreaktion kannst du wie folgt darstellen:
Redoxreaktion: Zn2+ + 2 I– -> Zn + I2
Wie du siehst, hat die Wirkung des elektrischen Stroms die chemische Verbindung Zinkiodid in die Elemente Zink und Iod aufgetrennt.
Elektrolyse Natriumchlorid
Die Elektrolyse von Natriumchlorid nennst du auch Kochsalzelektrolyse. Dabei wird Natriumchlorid durch einen elektrischen Strom zersetzt. Sie gehört zu den Chloralkalielektrolysen. Du verwendest dabei eine wässrige Lösung von Natriumchlorid als Elektrolyten.
Der Elektronenüberschuss an der Kathode führt dazu, dass die im Wasser vorhandenen Protonen (H+) ein Elektron aufnehmen (Reduktion). Dabei entsteht Wasserstoff (H2). Zusätzlich entstehen auch Hydroxidionen, die danach in Lösung gehen.
Die negativ geladenen Chlorionen (Cl–) sammeln sich an der Anode und geben ein Elektron (Oxidation) ab. Daraufhin bilden zwei Chloratome ein Chlormolekül (Cl2).
Die freien Natriumkationen (Na+) bilden zusammen mit den übrigen Hydroxidionen (OH–) eine verdünnte Natronlauge.
Die Reaktionsgleichung lautet:
2 NaCl + 2 H2O -> 2 NaOH + H2 + Cl2
Elektrolyse von Wasser
Durch die Elektrolyse von Wasser kannst du sogar Wasser in seine Ausgangsstoffe Wasserstoff (H2) und Sauerstoff (O2) zerlegen. Die Wasserelektrolyse besteht aus zwei verschiedenen Teilreaktionen an den beiden Elektroden.
Die Reaktionsgleichungen an der Kathode und der Anode sehen wie folgt aus:
Kathode: 2 H2O + 2e– -> H2 + 2 OH–
Anode: 2 H2O -> O2 + 4H+ + 4e–
Redoxreaktion: 2 H2O -> 2 H2 + O2
Wirkungsgrad Elektrolyse
Grundsätzlich ist die Elektrolyse ein sehr energieeffizienter Prozess mit einem Wirkungsgrad von über 70%. Wichtig dafür ist, dass du für den Prozess eine Spannung nahe an der Zersetzungsspannung wählst.
Um die Elektrolyse von Gasen zuverlässiger ablaufen zu lassen, wird ein gewisser Betrag an zusätzlicher Spannung benötigt. Diese „Überspannung“ ist stark von dem Elektrodenmaterial abhängig und reduziert oft auch den Wirkungsgrad der Reaktion.
Weiterhin kann ein Diaphragma den elektrischen Stromfluss behindern. Dadurch kann der Wirkungsgrad des gesamten Elektrolyseprozesses heruntergesetzt werden.
Elektrolyse Anwendungsgebiete
Die Elektrolyse findet insbesondere für verschiedenste technische Stofftrennungen Anwendung. Doch auch zur Metallbearbeitung und Abwasserreinigung kann sie verwendet werden. Nachfolgend beschreiben wir dir drei wichtige Anwendungsbereiche der Elektrolyse.
Chloralkalielektrolyse
Mit der Chloralkalielektrolyse kannst du aus einer wässrigen Lösung von Natriumchlorid die Produkte Chlor, Wasserstoff und Natronlauge erzeugen. Du kannst dabei zwischen drei technischen Verfahren unterscheiden:
Beim Diaphragmaverfahren werden der Kathoden- und der Anodenraum durch ein Diaphragma aus Asbest getrennt. Die Kathode besteht meist aus Stahl und die Anode aus beschichtetem Titan. Die Anoden- und Kathodenreaktionen setzen sich wie folgt zusammen:
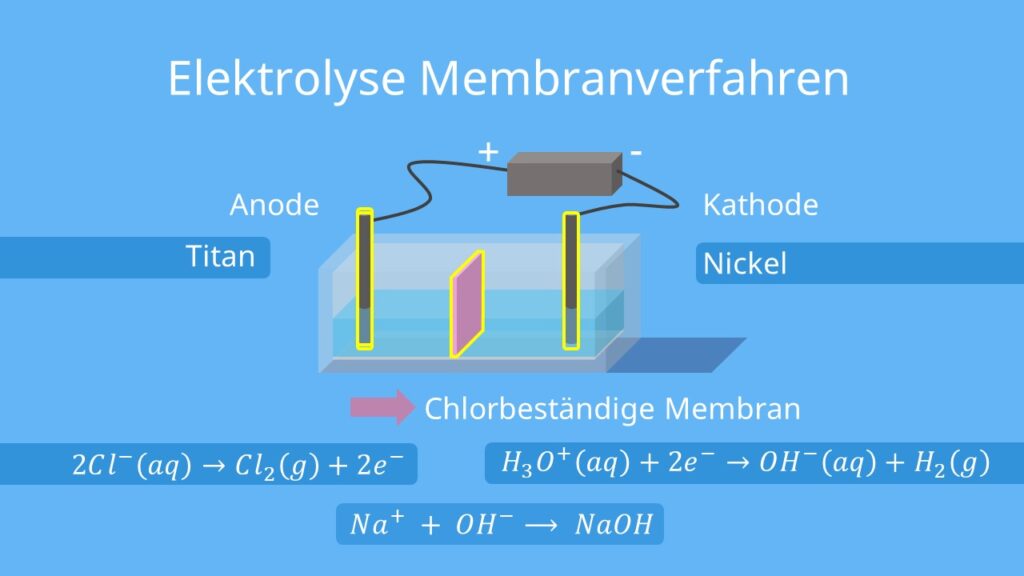
Anode: 2Cl–(aq) -> Cl2 (g) +2e–
Kathode: 2 H3O+(aq) + 2e– -> OH–(aq) + H2(g)
Die freien Natriumionen (Na+) bilden zusammen mit den entstandenen Hydroxidionen (OH–) Natronlauge (NaOH) bis zu einer Konzentration von ca. 15%.
Die zweite Methode ist das sogenannte Membranverfahren. Hierbei wird das Diaphragma durch eine dünne chlorbeständige Membran ersetzt. Wie beim Diaphragmaverfahren besteht die Anode aus Titan, die Kathode jedoch aus Nickel. Die chemischen Reaktionen entsprechen denen des Diaphragmaverfahrens.
Als dritte und letzte Methode zur Chloralkalielektrolyse kannst du das Amalgamverfahren verwenden. Dieses besteht aus einer Titan-Anode und einer Quecksilber-Kathode. Das an der Kathode gebildete Natrium löst sich in dem Quecksilber als Natriumamalgam auf. Durch diese Reaktion erhält das Amalgamverfahren auch seinen Namen.
Theoretisch können folgende Elektrodenreaktionen ablaufen:
Anode:
2 Cl–(aq) -> Cl2(g) + 2e–
4 OH–(aq) -> O2(g) + 2 H2O +4e–
Kathode:
Na+(aq) + e– -> Na
2 H3O+(aq) + 2e– -> H2 + 2 H2O
Das Natrium reagiert an der Quecksilber-Kathode sofort zu Natriumamalgam.
Na/Hgx
Wenn du nun Natronlauge aus der Reaktion erhalten willst, dann muss dein Natriumamalgam in einer weiteren Kammer, dem Amalgamzersetzer, zur Reaktion gebracht werden. Durch die Reaktion mit Wasser zersetzt sich das Natrumamalgan zu Natronlauge:
2 Na/Hgx + 2 H2O -> 2 NaOH(aq) + H2(g)
Als Gesamtreaktion erhältst du:
2 NaCl(aq) + 2 H2O -> 2 NaOH(aq) + Cl2(g) + H2(g)
Kolbe Elektrolyse
Bei der Kolbe Elektrolyse werden Carbonsäuren oder dessen Salze (Carboxylate) gespalten. Ziel dieser Reaktion ist es, zwei Reste aneinander zu kuppeln. Zuerst entstehen dabei Radikale, die dann zu verschiedenen Kohlenwasserstoffen weiterreagieren können. So konnte der Entdecker der Reaktion Herrmann Kolbe beispielsweise aus Essigsäure Ethan herstellen.
Galvanik
In der Galvanik, oder auch Galvanotechnik, wird die Elektrolyse zur Abscheidung von Metallen verwendet. Da die Qualität eines Werkstücks oft von seinem metallischen Glanz abhängig ist, ist die Effektivität der Elektrolyse hier besonders wichtig.
Elektrolyse — häufigste Fragen
(ausklappen)
Elektrolyse — häufigste Fragen
(ausklappen)-
Wie entscheide ich bei einer Elektrolyse schnell, welche Stoffe an Anode und Kathode wirklich reagieren, wenn mehrere Ionen in der Lösung sind?Entscheidend sind die Elektrodenpotenziale und die Überspannungen der möglichen Teilreaktionen. An der Kathode setzt sich meist die Reduktion mit dem höheren (leichter reduzierbaren) Reduktionspotenzial durch, an der Anode die Oxidation mit dem leichteren Verlauf unter realen Bedingungen. Beispiel: In wässrigem NaCl entsteht oft H2 statt Na.
-
Was ist der Unterschied zwischen Zersetzungsspannung und Überspannung in einer echten Elektrolyse?Die Zersetzungsspannung ist die theoretische Mindestspannung, ab der die Reaktion thermodynamisch möglich ist. Die Überspannung ist die zusätzliche Spannung, die wegen langsamer Elektrodenkinetik (Reaktionshemmung an der Oberfläche) praktisch nötig wird. Deshalb braucht Wasserelektrolyse real mehr Spannung als berechnet.
-
Welche typischen Fehler passieren beim Aufstellen der Teilgleichungen an Anode und Kathode bei Elektrolysen?Häufig werden Anode und Kathode vertauscht oder Elektronen auf die falsche Seite geschrieben. Außerdem werden Ladungen nicht ausgeglichen oder in wässriger Lösung H2O, H+ und OH- beim Ausgleichen vergessen. Achte darauf: Kathode ist Reduktion (e- Aufnahme), Anode ist Oxidation (e- Abgabe).
-
Wie erkenne ich am Vorzeichen der Zellspannung, ob ich eine Elektrolyse oder eine galvanische Zelle vor mir habe?An einer positiven Zellspannung (
 ) erkennst du eine galvanische Zelle, weil die Reaktion freiwillig Strom liefert. Ist die berechnete Zellspannung negativ (
) erkennst du eine galvanische Zelle, weil die Reaktion freiwillig Strom liefert. Ist die berechnete Zellspannung negativ ( ), läuft die Reaktion nicht spontan und braucht eine äußere Spannung. Das entspricht einer Elektrolyse.
), läuft die Reaktion nicht spontan und braucht eine äußere Spannung. Das entspricht einer Elektrolyse.
-
Wie kann ich mit dem Faraday-Gesetz aus Strom und Zeit berechnen, wie viel Stoff bei einer Elektrolyse entsteht?Du berechnest zuerst die Ladung mit
 und dann die Stoffmenge Elektronen mit
und dann die Stoffmenge Elektronen mit  (Faraday-Konstante
(Faraday-Konstante  ). Anschließend teilst du durch die benötigte Elektronenzahl z:
). Anschließend teilst du durch die benötigte Elektronenzahl z:  . Beispiel: Für H2 gilt z = 2.
. Beispiel: Für H2 gilt z = 2.
Galvanische Zelle
Du hast nun den Aufbau, das Prinzip und einige Beispiele der Elektrolyse kennengelernt. Dabei kannst du durch Strom eine chemische Reaktion erzwingen. Allerdings können chemische Reaktionen in galvanischen Zellen auch umgekehrt Strom liefern. Schau dir jetzt unseren Beitrag an, um mehr darüber zu erfahren!