Potentiometrie
Die Potentiometrie ist eine Form der Titration, bei der du mithilfe einer Spannungsmessung die Konzentration deiner Probelösung bestimmen kannst. Alle Details dazu findest du hier in unserem Artikel.
Willst du den ganzen Inhalt lieber in audiovisueller Form aufbereitet sehen, schau dir doch einfach unser Video an!
Inhaltsübersicht
Potentiometrie einfach erklärt
Da die Potentiometrie eine Form der Titration ist, ist der grundlegende Ablauf der Titration gleich. Der einzige Unterschied zur traditionellen Titration ist die Erfassung des Äquivalenzpunktes. Diesen bestimmst du hier nicht mehr über einen Indikator, sondern durch die Messung des elektrochemischen Potentialunterschieds zwischen Maßlösung und einer Bezugselektrode auf konstantem Potential.
Diese Titrationsmethode verwendest du immer dann, wenn du keinen passenden Indikator finden kannst oder die starke Färbung der Probelösung das Erkennen des Farbumschlags unmöglich macht. Wenn du vor dem Weiterlesen nochmals die Grundlagen der Titration erläutert bekommen möchtest, dann schau dir unseren Artikel zur Titration an.
Potentiometrie Versuchsaufbau
Wenn du die Titration potentiometrisch durchführen möchtest, dann brauchst du sowohl eine Bezugselektrode als auch eine Messelektrode. Die Bezugselektrode ist meistens eine Elektrode 2. Art. Diese zeichnen sich dadurch aus, dass ihr Potential konstant und nicht konzentrationsabhängig ist. Die Messelektrode dagegen weist ein Potential auf, welches abhängig von der Konzentration in deiner Messlösung ist. Änderst du also durch Neutralisation die Konzentration der Probelösung, ändert sich auch das Potential deiner Messelektrode. Diese Änderung erfasst du bei der Potentiometrie dann durch die stetige Spannungsmessung des konstanten Potentials gegenüber deiner Bezugselektrode.
Wenn du dich mit Elektrochemie schon gut auskennst, dann weißt du bestimmt auch, dass sich durch einen Stromfluss diese Spannungsdifferenz ebenfalls über die Zeit ändern würde. Da du aber möchtest, dass die Neutralisation der Probelösung die einzige Quelle deiner Potential-Änderungen sein soll, blockierst du diesen Strom durch eine Spannungs-Kompensationsschaltung. Über die kannst du die Spannung messen ohne Gefahr einer Verfälschung deiner Ergebnisse.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Potentiometrie Grundlagen
Da du jetzt die grundlegenden Abläufe verstanden hast, fragst du dich bestimmt schon, wie du jetzt aus dem erfassten Spannungsverlauf erkennen kannst, wann du denn den Äquivalenzpunkt erreicht hast. Um das zu beantworten, muss man sich die Nernst-Gleichung anschauen. Falls dir diese Gleichung noch nichts sagt, dann schau dir doch gleich den Artikel hier dazu an.
Spannungsbestimmung
Die Nernst-Gleichung beschreibt dir den Spannungsverlauf einer Elektrode, die in Kontakt mit einer Elektrolytlösung steht, in Abhängigkeit der Konzentration.

-
 = Spannung an Elektrode
= Spannung an Elektrode -
 = Normalspannung
= Normalspannung -
 = stöchiometrischer Koeffizient
= stöchiometrischer Koeffizient -
 = Ladungszahl des Ions
= Ladungszahl des Ions -
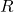 =ideale Gaskonstante
=ideale Gaskonstante -
 =Temperatur
=Temperatur -
 =Faraday-Konstante
=Faraday-Konstante -
 = Konz. reduzierte \ Form
= Konz. reduzierte \ Form -
 = Konz. oxidierte \ Form
= Konz. oxidierte \ Form
Anhand dieser Gleichung kannst du die Spannung deiner Messelektrode zu einer Normalelektrode nachvollziehen. Normalerweise besteht aber dein Versuchsaufbau sowohl aus einer Messelektrode als auch aus einer Referenzelektrode. Du erfasst also die Spannungsdifferenz zwischen diesen beiden Elektroden. Da aber die Spannung der Referenzelektrode stets konstant ist, kannst du den Spannungsverlauf leicht ausrechnen. Dafür nimmt man auch an, dass die zu titrierende Substanz als Ion in einer Lösung vorliegt und durch Zugabe der Maßlösung nach folgender Gleichung reagieren wird.

Ox=Oxidierte Form; Red=Reduzierte Form n=ganze Zahl; e=Elektron
Ist das der Fall, kann man ganz einfach die Spannung berechnen, indem man das konstante Potential der Bezugselektrode von der konzentrationsabhängigen Messelektrode abzieht.

-
 = Normalspannung des zu titrierenden Stoffs
= Normalspannung des zu titrierenden Stoffs -
 = Konzentration des zu titrierenden Stoffs in ox. Form
= Konzentration des zu titrierenden Stoffs in ox. Form -
 = stöchiometrischer Koeffizient des oxidierten/reduzierten Form
= stöchiometrischer Koeffizient des oxidierten/reduzierten Form -
 = Potential von Kathode bzw. Anode
= Potential von Kathode bzw. Anode
Äquivalenzpunktbestimmung
Das Potential der Referenzelektrode variiert je nach verwendetem Material. Häufig verwendete Elektroden sind die Ag/AgCl-Elektrode oder die Kalomel-Elektrode (Hg/HgCl).
Wenn man sich nun diese Gleichung anschaut, erkennt man, dass der Spannungswert sich dann stark ändern wird, wenn die Konzentrationen der oxidierten und reduzierten Form gleich groß sind. Bei weiterem Fortschreiten der Reaktion unterschreitet nämlich die ln-Funktion den Wert 1 und dadurch steigt deren Steigung stark an. Dieser Anstieg ist in der Messkurve dann auch klar erkennbar. Innerhalb dieses Sprungs der Spannung findest du dann auch deinen Äquivalenzpunkt. Wenn du dich noch näher mit dem Äquivalenzpunkt auseinandersetzen möchtest, dann klicke doch hier .
Potentiometrie Auswertung des Messkurven
Trägt man nun die gemessene Spannung gegen das hinzu gegebene Volumen an Maßlösung auf, so ergibt sich wieder ein für die Titration typischer Verlauf.
Wie man hier erkennen kann, ergibt sich auch hier wieder ein Verlauf mit einem steilen Anstieg. Dieser Anstieg kommt ähnlich wie bei der Säure-Base-Titration durch das Erreichen des Äquivalenzpunktes zustande. Auch bei dieser Kurve kann man durch grafisches Ermitteln des Wendepunktes der Kurve auch den Äquivalenzpunkt herausfinden. Dafür bietet sich zum Beispiel das Tangentenverfahren oder das Kreisverfahren an.
Möchtest du das Tangentenverfahren anwenden, musst du nur zwei Tangenten an den Knickpunkten der Kurven einzeichnen. Diese sollten mit der x-Achse einen Winkel von ungefähr 45º einschließen. Dann musst du nur noch eine dritte, zu den beiden anderen Tangenten parallele, Gerade ziehen. Diese sollte genau in der Mitte der beiden liegen. Der Schnittpunkt dieser dritten Gerade ist dann dein Äquivalenzpunkt.
Kennt man also die Spannung, bei der der Äquivalenzpunkt erreicht worden ist, kann man die Nernst Gleichung umstellen und so die Konzentration der Probelösung am Äquivalenzpunkt ausrechnen. Um die ursprüngliche Konzentration zu ermitteln, muss man nun noch die Stoffmenge hinzurechnen, die bei Erreichen des Äquivalenzpunktes schon mit der Maßlösung abreagiert hat. Da man ja auch aus dem Diagramm herauslesen kann, wie viel Maßlösung beim Äquivalenzpunkt schon in die Probelösung getropft ist, kann man auch die abreagierte Stoffmenge berechnen:

- n=Stoffmenge der Maßreagenz in der Probelösung am Äquivalenzpunkt
-
 = hinzugegebenes Volumen an Maßlösung am Äquivalenzpunkt
= hinzugegebenes Volumen an Maßlösung am Äquivalenzpunkt -
 = Konzentration der Maßlösung
= Konzentration der Maßlösung
Über die Reaktionsgleichung der Titration kannst du dann auch berechnen, welche Stoffmenge in der Probelösung verbraucht worden ist. Diese musst du dann nur noch zur bereits bekannten Äquivalenzpunkt-Stoffmenge addieren. Bezogen auf das Volumen der Probelösung erhältst du dann die Ausgangskonzentration.
Potentiometrie Anwendungsfelder
Da die Potentiometrie eine sehr vielfältig einsetzbare Methode ist, trifft man sie auch in vielen Anwendungsfeldern an. Du kannst damit zum Beispiel Löslichkeitsprodukte messen oder auch ganz klassisch die Konzentrationen von beliebigen Lösungen bestimmen. Ein sehr wichtiges Einsatzgebiet ist aber vor allem die Säure-Base Titration.
Säure-Base Titration mittels Potentiometrie
Da der Einsatz von Indikatoren oftmals zu etwas ungenauen Titrationsergebnissen führt, hat man schon früh nach Alternativen Messmethoden gesucht und sie in der Potentiometrie gefunden. Für die Messung selbst während der Titration benutzt man normalerweise eine spezielle Glaselektrode.
Diese Elektrode ist so konstruiert, dass sie beide Elektroden, also Referenz- und Messelektrode, gleichzeitig enthält. Jedoch sind diese beiden räumlich getrennt voneinander und nur über einen leitenden Draht miteinander verbunden, um die Spannung zwischen den beiden zu messen. Die Referenzelektrode ist, wie vorher auch, eine Ag/AgCl- oder eine Kalomelelektrode. Die Messelektode selbst taucht in eine Lösung mit dem pH-Wert 7 ein. Zusätzlich enthält die Lösung einen Puffer, um den pH-Wert stabil zu halten. Wenn du nochmal den Begriff des pH-Werts wiederholen möchtest, dann klicke doch hier .
Der entscheidende Teil der Glaselektrode ist eine Glasmembran, die in die Probelösung eintaucht. Die eine Seite der Glasmembran taucht in die Probelösung ein. Die andere Seite dagegen steht in Kontakt mit der Pufferlösung, in der sich auch die Messelektrode befindet. Nun muss man wissen, dass in den meisten Gläsern Ionen eingelagert sind, wie  -Ionen. Diese sind aber aufgrund der amorphen Struktur des Glas sehr beweglich. Außerdem können sich die Oxonium-Ionen einer Lösung an der Oberfläche der Glasmembran anlagern, aber diese nicht durchdringen.
-Ionen. Diese sind aber aufgrund der amorphen Struktur des Glas sehr beweglich. Außerdem können sich die Oxonium-Ionen einer Lösung an der Oberfläche der Glasmembran anlagern, aber diese nicht durchdringen.
Durch die zusätzliche Ladung an der Oberfläche werden die Li-Ionen im Glas von der Oberfläche zurückgedrängt. Wie viele Oxonium-Ionen sich dabei anlagern ist abhängig von der jeweiligen Konzentration der Oxonium-Ionen in der angrenzenden Lösung. Je höher sie ist, desto mehr werden sich anlagern. Ist also der pH-Wert auf den beiden Seiten der Glasmembran unterschiedlich, so ist das Bestreben der Oxonium-Ionen, sich an die Membran anzulagern, auch unterschiedlich. Dementsprechend ergibt sich auch ein Ladungsunterschied zwischen den beiden Seiten der Glasmembran und darüber eine resultierende Spannung. Diese Spannung lässt sich dann über die beiden Elektroden erfassen.
Donnan Gleichung
Da es hier keinen Redoxprozess an sich gibt, kann man auch nicht ohne Probleme die Nernst-Gleichung heranziehen, um die Spannung zu berechnen. Stattdessen muss man die Donnan-Gleichung heranziehen. Diese sieht aber sehr ähnlich zur Nernst Gleichung aus:

-
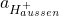 = Aktivität der Oxonium-Ionen außen
= Aktivität der Oxonium-Ionen außen -
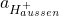 = Aktivität Oxonium-Ionen innen
= Aktivität Oxonium-Ionen innen
Willst du nun eine Lösung titrieren, kannst du die pH-Wert Veränderungen mit dieser Methode leicht messen, da ja die Aktivität der Innenseite aufgrund des Puffers und der Undurchlässigkeit der Membran ja stets gleich bleibt. Eine Veränderung der gemessenen Spannung an der Glaselektrode kann also nur durch eine pH-Wert Veränderung der Lösung an der äußeren Schicht zustande kommen. Möchtest du nun den pH-Wert mitverfolgen, was für eine Säure-Base Titration nötig ist, kannst du also die obige Gleichung leicht nach der Aktivität/Konzentration der Oxonium-Ionen an der äußeren Schicht umstellen.




