Gaschromatographie
Du sprichst in deiner Vorlesung gerade die grundlegenden Analysetechniken in der Chemie durch? Hast dabei von der Gaschromatographie erfahren und möchtest jetzt mehr über dieses spannende Thema erfahren? Dann bist du hier richtig, hier erklären wir dir wie du mit der Gaschromatographie Gemische trennst und auch ihren Mengenanteil bestimmen kannst.
Falls du lieber die ganzen Infos geballt in einem Video anschauen möchtest, dann klicke doch auf das Video !
Inhaltsübersicht
Gaschromatographie einfach erklärt
Zuerst einmal solltest du wissen, worum es bei der Gaschromatographie (engl. : gas chromatography) geht.
Grundprinzip für den Trennvorgang ist dabei, dass die Bestandteile deiner Probe unterschiedliche Dampfdrücke haben und so unterschiedlich schnell in die Gasphase übergehen.
Gaschromatograph Aufbau und Funktion
Um das Prinzip der Gaschromatographie zu verstehen, schaust du dir am besten am Anfang folgendes Schema eines Gaschromatographen an.
Zuerst gibt man die Substanz, die man analysieren möchte in den Injektor. Dort erhitzt man sie auf bis zu 450°C, wobei alle Substanzen restlos in die Gasphase übergehen. Die nötige Temperatur stimmt man dabei immer auf die Siedepunkte der einzelnen Komponenten ab. Jedoch können wegen den nötigen, hohen Temperaturen nur solche chemischen Verbindungen analysiert werden, die in die Gasphase überführt werden können und sich nicht zu schnell zersetzen.
Die nun gasförmige Probe wird dann über einen Trägergasstrom (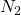 ,
, ) in die Säule getragen, wo der eigentliche Trennprozess beginnt. Die Säule ist ein aufgewickelter Schlauch, der eine sehr geringe Dicke von unter 1 mm aufweist. Das Trägergas ist dabei inert und wechselwirkt weder mit der Probe noch mit den Bestandteilen der Säule, um die Messergebnisse nicht zu beeinflussen.
) in die Säule getragen, wo der eigentliche Trennprozess beginnt. Die Säule ist ein aufgewickelter Schlauch, der eine sehr geringe Dicke von unter 1 mm aufweist. Das Trägergas ist dabei inert und wechselwirkt weder mit der Probe noch mit den Bestandteilen der Säule, um die Messergebnisse nicht zu beeinflussen.
Nun trennen sich die Substanzen aus dem Gasstrom immer weiter auf, da sie von der stationären Phase in der Säule unterschiedlich stark adsorbiert werden. Mit zeitlicher Verschiebung zueinander kommen dann die Substanzen einzeln am Ende der Säule an, wo ein Detektor sie einzeln erfasst.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Gaschromatographie stationäre Phase
Wenn man nun das Grundprinzip verstanden hat, kann man sich dann die einzelnen Komponenten in der Gaschromatographie genauer anschauen. Zuerst zur stationären Phase. An ihr adsorbieren die einzelnen Substanzen der Probe während sie im Gasstrom an ihr vorbeifließen. Dabei gibt es zwei Ausführungen der stationären Phase: Säulen mit Packung oder Kapillarsäulen.
Gaschromatographie Säulen Varianten
Die erste Version mit Packung beschreibt dabei eine Bauart, in der die Säule voll gepackt ist mit der stationären Phase. So kann das Gas immer nur durch kleine Spalte hindurchfließen, die zudem sehr unregelmäßig durch die Säule verlaufen. Bei dieser Bauart ergibt sich das Problem, dass die Wegstrecke, die die Moleküle eines Bestandteiles der Probe in der Säule zurücklegen, variiert. Denn je nach Spalt, den das Molekül wählt, wird der Weg kürzer oder länger. Dadurch kommt der Bestandteil der Probe über einen breiteren Zeitraum verteilt oben beim Detektor an und die Trennwirkung schwächt sich dadurch ab.
Die zweite Version arbeitet mit einer sogenannten Kapillarsäule. Dort ist die stationäre Phase auf der Innenseite der Säule gleichmäßig wie ein Mantel aufgetragen, wodurch die zurückgelegte Weglänge der einzelnen Moleküle in der Gasphase weniger variiert. Die Säule wird meistens auf einer Temperatur betrieben, bei der diese stationäre Phase in der Flüssigphase vorliegt. So findet dann eine Absorption anstatt einer Adsorption statt.
Gaschromatographie Trennung über Dampfdrücke
Grundlegend erfolgt in der Gaschromatographie schon eine Trennwirkung unabhängig von der Wahl der stationären Phase, unter der Bedingung, dass die einzelnen Bestandteile der Probe unterschiedliche Siedepunkte aufweisen. Dann liegt nämlich bei gegebener Temperatur der Bestandteil der Probe bevorzugt in der Gasphase vor, der den höheren Dampfdruck aufweist. Sehen kann man das anhand des Raoultschen Gesetzes für ideale Gase:

 = Partialdruck der Komponente i;
= Partialdruck der Komponente i;  = Molenbruch der Komponente i;
= Molenbruch der Komponente i;
 = Dampfdruck der reinen Komponente i
= Dampfdruck der reinen Komponente i
Hieran sieht man je höher der Dampfdruck reinen Komponente ist, desto höher ist auch der Partialdruck, den die Komponente im Gemisch ausmachen wird. Die Trennwirkung in der Gaschromatographie erfolgt dann dadurch, dass Komponenten nur in der Gasphase wandern können und je mehr sie in der Gasphase vorhanden sind, desto schneller wandern sie. Durch eine ausreichende Länge der Säule erfolgen für jedes Molekül eines Bestandteils ausreichend oft der Übergang zwischen Gas und Flüssigphase, wodurch statistische Ausreißer minimiert werden können.
Gaschromatographie Trennung über Polarität
Hat man jedoch eine Probe, in der die Bestandteile sehr ähnliche Dampfdrücke aufweisen, wird diese Taktik in der Gaschromatographie nicht ausreichen. Dann fällt die Wahl der stationären Phase stark ins Gewicht. Hier kann man durch die Anpassung der Polarität der stationären Phase ebenfalls polare Bestandteile der Probe länger in der gelösten Phase halten und somit im Wandern verlangsamen.
Für eine Trennung gemäß der Siedepunkte verwendet man Polydimethylsiloxan als stationäre Phase, das nur unpolare Eigenschaften aufweist. Dies sieht folgendermaßen aus:
Für eine Trennung nach polaren Eigenschaften, kann man die Methylgruppen auch gegen Cyanidgruppen austauschen, die polare Moleküle stärker binden:
Gaschromatographie mobile Phase
Mit der mobilen Phase ist in der Gaschromatographie das Trägergas gemeint, das die Probenbestandteile durch die Säule treibt. Dabei ist das Trägergas inert, reagiert also weder mit der stationären Phase noch mit den Bestandteilen der Proben.
Die Wahl des Trägergases ist nur insofern relevant, als dass in Gasen mit unterschiedlichen Viskositäten die Probenmoleküle unterschiedlich schnell diffundieren können. Dadurch ergibt sich einerseits, dass die Probenmoleküle bei hoher Gasviskosität weniger häufig einen Phasenwechsel vollziehen und somit statistische Schwankungen das Messergebnis verschlechtern. Andererseits verlangsamt eine höhere Viskosität auch die Diffusion der Probenmoleküle innerhalb der mobilen Phase in Längsrichtung der Säule, da auch dort ein Konzentrationsgradient existiert. Dieser Faktor würde das Messergebnis wieder verbessern.
Experimente haben jedoch gezeigt, dass eine geringere Viskosität insofern besser ist, als dass man dann die Strömungsgeschwindigkeiten innerhalb der Säule erhöhen kann und dann die Messzeiten für eine Probe sich deutlich verkürzen. Und das bei gleichbleibender Qualität des Messergebnisses.
Gaschromatographie Injektor
Der Injektor dient in der Gaschromatographie dazu, die Probe aufzuheizen und in die Gasphase zu bringen. Diese wird dann gleichzeitig durch einen Trägerstrom weitergeleitet.
Dabei gibt es oft noch die Möglichkeit in einem Splitless/Split Injektor die Menge an Probe, die in die Säule fließt zu regulieren. Dabei wird das mit der Probe angereicherte Gas in je nach Bedarf anteilsmäßig in 2 Ströme aufgeteilt, wobei nur einer durch die Säule fließt. Die Anteile der Ströme lassen sich dabei frei einstellen. Dadurch kann man eine Überladung verhindert werden. Das heißt, dass die mobile Phase übersättigt wird an Probenmolekülen, die später dann in der Säule auskondensieren. Erst nachkommendes Gas kann dann die Moleküle wieder aufnehmen und weiter wandern lassen. Dadurch verschlechtert sich die Trennwirkung in der Gaschromatographie wiederum, da die Moleküle über einen breiteren Zeitraum verteilt am Detektor ankommen.
Gaschromatographie Detektor
Der Detektor hat in der Gaschromatographie die Aufgabe darzustellen, wann und in welcher Konzentration ein Bestandteil der Probe oben am Ende der Säule angelangt ist. Dadurch kann man dann für jeden Probenbestandteil die Zeit, die eine Komponente gebraucht hat, auftragen gegen die vom Detektor erfasste Intensität des Bestandteils. Die Intensität und Fläche eines Peaks ist idealerweise proportional zur enthaltenen Menge an Probe im Gasstrom.
Der am häufigsten verwendete Detektor ist der FID (Flammenionisationsdetektor). Dabei werden die Probenmoleküle durch eine Wasserstoff-Flamme geleitet. Die Temperaturen dort reichen aus, um die Proben zu ionisieren. Die dabei frei werdenden Elektronen werden dann durch Kondensatorplatten, die seitlich angebracht sind, aufgefangen. Dadurch entsteht ein kurzer elektrischer Stromfluss, der detektiert wird. Die Stärke des Stroms lässt dabei Rückschlüsse auf die enthaltene Menge an Probe zu.
Man kann den Gaschromatographen allerdings auch mit einem Massenspektrometer verbinden, der anschließend auch noch eine Struktur-Aufklärung der Bestandteile ermöglicht.
Gaschromatographie Auswertung
Wie schon gesagt, trägt man das Ergebnis als Retentionszeit gegen die Signalintensität auf. Die Retentionszeit ist dabei die Zeit, die der Probenbestanteil vom Injektor zum Detektor gebraucht hat. Bei dieser Auftragung ergeben sich dann Peaks, die folgendermaßen aussehen können:
Dabei sollte man immer darauf achten, dass die Peaks möglichst symmetrisch wie eine Gaußkurve aussehen. Ist dies nicht der Fall, ist die Chromatographie noch nicht optimal eingestellt. Dann kann es sein zum Beispiel der Fall sein, dass die Säule mit der Probenmenge überladen wurde. Weiterhin sollten die Peaks möglichst gut voneinander getrennt und möglichst dünn vorliegen, um eine Identifizierung zu ermöglichen.
Gaschromatographie qualitative Auswertung
Qualitativ kannst du die Probe meistens über Spektrometer identifizieren, die an den Gaschromatographen angeschlossen sind. Denn hierfür liegen weit mehr Vergleichsdaten aus Datenbanken vor, mit denen erhaltene Spektrogramme abgeglichen werden können.
Alternativ kann man auch so vorgehen, dass man die Probe mit mehreren Vergleichssubstanzen mischt und dann durch den Gaschromatographen schickt. Erkennt man auf dem erhaltenen Diagramm eine Peakaufspaltung, dann ist die Vergleichssubstanz nicht enthalten. Ergibt sich jedoch bloß eine Erhöhung der Intensität der Peaks, dann ist die Vergleichssubstanz wahrscheinlich vorhanden.
Gaschromatographie quantitative Auswertung
Wesentlich häufiger werden die Chromatogramme für die Analyse der quantitativen Zusammensetzung herangezogen. Für eine Bestimmung benötigt man jedoch eine Referenz. Dazu mischt man eine weitere Substanz zur Probe hinzu, von der man also die Masse und damit die Konzentration in der Probe kennt. Dann schickt man die Probe durch den Chromatographen. Die zusätzliche Substanz ist dabei so gewählt, dass ihr Peak sehr nahe beim zu quantifizierenden Peak liegt. Nun kann man die Flächen der Peaks zueinander referenzieren, da man nun das Verhältnis zwischen Fläche eines Peaks und der zugehörigen Masse/Konzentration kennt. Um die Konzentration des gesuchten Bestandteils zu ermitteln, kann man dann in die folgende Formel einsetzen:

 = gesuchte Konz. ;
= gesuchte Konz. ; 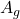 = Peakfläche der gesuchten Substanz;
= Peakfläche der gesuchten Substanz;  = Peakfläche der Referenz;
= Peakfläche der Referenz;
 = Peakintensität der Referenz;
= Peakintensität der Referenz;  = Peakintensität der gesuchten Substanz
= Peakintensität der gesuchten Substanz





