Reaktionsgeschwindigkeit
In diesem Beitrag erklären wir dir, was du dir unter der Reaktionsgeschwindigkeit in der Chemie vorstellen kannst, wie ihre Formel aussieht und wie du sie berechnen kannst.
Du willst den Inhalt dieses Artikels noch schneller verstehen? Dann schau dir gerne unser zugehöriges Video zum Thema an!
Inhaltsübersicht
Reaktionsgeschwindigkeit einfach erklärt
Die Reaktionsgeschwindigkeit ist eine Größe der chemischen Kinetik. Mit ihr kannst du angeben, wie schnell eine Reaktion abläuft. Genauer gesagt gibt sie die Konzentrationsänderung der reagierenden Ausgangsstoffe in einer bestimmten Zeit an.
![Rendered by QuickLaTeX.com v = \frac {\Delta c}{\Delta t} [\frac {mol}{l \cdot s}]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-57295db7e2fbb0608067a9983cb87b59_l3.png)
Die Reaktionsgeschwindigkeit ist von mehreren Faktoren abhängig. Zwei wichtige dieser Faktoren sind die Konzentration der Ausgangsstoffe und die Temperatur, bei der die Reaktion abläuft. Daneben hängt sie außerdem von der Verwendung eines Katalysators, des pH Wertes, einer Druckänderung und der Oberfläche der reagierenden Stoffe ab.
Die Reaktionsgeschwindigkeit ist ein Maß dafür, wie viele Teilchen in einem bestimmten Volumen (= Konzentration) pro Zeit in einer chemischen Reaktion umgesetzt werden. Ihre Einheit wird in  angegeben.
angegeben.
Reaktionsgeschwindigkeit Chemie
Die Reaktionsgeschwindigkeit ist insbesondere ein wichtiger Parameter in der anorganischen Chemie. Grundsätzlich wird er in den verschiedensten Zusammenhängen zur Beschreibung einer Reaktion verwendet.
Wichtige Anwendungsfälle sind beispielsweise bei der sogenannten RGT-Regel oder dem Massenwirkungsgesetz .
Die Reaktionsgeschwindigkeit Temperatur Regel besagt, dass die Geschwindigkeit einer Reaktion bei einer Temperaturerhöhung von 10°C zwei- bis viermal so schnell abläuft.
Das Massenwirkungsgesetz gibt an, dass bei Reaktionen in einem dynamischen Gleichgewicht die Hin- und Rückreaktion mit einer gleichen Geschwindigkeit ablaufen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Reaktionsgeschwindigkeit Formel
Die Formel für die Reaktionsgeschwindigkeit sieht wie folgt aus:
![Rendered by QuickLaTeX.com v = \frac {\Delta c}{\Delta t} [\frac {mol}{l \cdot s}]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-57295db7e2fbb0608067a9983cb87b59_l3.png)
Das  bezeichnet jeweils die Änderung der einzelnen Werte. Das
bezeichnet jeweils die Änderung der einzelnen Werte. Das  gibt die Konzentration
, also wie viel von einem Stoff in einem Vergleichsvolumen enthalten ist, an. Seine Einheit ist
gibt die Konzentration
, also wie viel von einem Stoff in einem Vergleichsvolumen enthalten ist, an. Seine Einheit ist  .
.  ist der Wert für die Zeit. Für die Reaktionsgeschwindigkeit wird
ist der Wert für die Zeit. Für die Reaktionsgeschwindigkeit wird  meist in Sekunden angegeben. Die Änderung der Konzentration pro Zeit wird vor allem in Flüssigkeiten angegeben.
meist in Sekunden angegeben. Die Änderung der Konzentration pro Zeit wird vor allem in Flüssigkeiten angegeben.
Neben der Formulierung einer Reaktionsgeschwindigkeit über die Konzentration existieren auch noch zwei unüblichere Darstellungen.
Eine weitere Formel bezieht die Änderung der sogenannten Stoffmenge
des Produktes mit ein ( ):
):
![Rendered by QuickLaTeX.com v = \frac {\Delta n_{Produkt}}{\Delta t} [\frac {mol}{s}]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-59638c8f5a8f8bbce01dd3963f56592f_l3.png)
Bei Feststoffen kannst du die Reaktionsgeschwindigkeit als die Änderung der Masse  pro Zeit angeben:
pro Zeit angeben:

Reaktionsgeschwindigkeit berechnen
Betrachten wir die Reaktion des Eduktes A zu einem beliebigen Produkt B:

Nun wollen wir die Reaktionsgeschwindigkeit über die Konzentration berechnen.
Bei einer bekannten Anfangskonzentration  und einer Zeit vom Reaktionsanfang
und einer Zeit vom Reaktionsanfang  bis zum Ende
bis zum Ende  musst du nur noch die Endkonzentration
musst du nur noch die Endkonzentration  messen.
messen.
Wichtig ist hierbei, dass du jeweils entweder die Anfangs- und Endkonzentration ( &
&  ) des Eduktes A oder die des Produktes B nehmen kannst, da diese sich in einer Reaktion in gleichem Maße ändern. Diese Umsetzung von Edukt zu Produkt wird durch folgenden Graphen veranschaulicht:
) des Eduktes A oder die des Produktes B nehmen kannst, da diese sich in einer Reaktion in gleichem Maße ändern. Diese Umsetzung von Edukt zu Produkt wird durch folgenden Graphen veranschaulicht:
Mit einem solchen Graphen kannst du Reaktionsgeschwindigkeiten ebenfalls grafisch berechnen. So lässt sie sich entweder durch ein Steigungsdreieck oder für einen beliebigen Punkt mit einer Tangente bestimmen.
Eine negative Reaktionsgeschwindigkeit ( ) bezieht sich immer auf die Abnahme der Eduktkonzentration während einer bestimmten Zeit.
) bezieht sich immer auf die Abnahme der Eduktkonzentration während einer bestimmten Zeit.
Eine positive Reaktionsgeschwindigkeit ( ) beschreibt dementsprechend eine Zunahme der Produktkonzentration während dieser Zeit.
) beschreibt dementsprechend eine Zunahme der Produktkonzentration während dieser Zeit.
Schauen wir uns dazu ein allgemeines Beispiel an:
Nehmen wir an, du hast ein beliebiges Edukt mit der Konzentration  . Nach der Reaktion beträgt seine Konzentration
. Nach der Reaktion beträgt seine Konzentration  . Die Reaktion dauert 10 Sekunden.
. Die Reaktion dauert 10 Sekunden.
Das bedeutet du erhältst eine Reaktionsgeschwindigkeit von:

Reaktionsgeschwindigkeit Abhängigkeiten
Reaktionsgeschwindigkeiten sind von mehreren Faktoren abhängig. Dazu ist es wichtig, dass du ein Grundverständnis von chemischen Reaktionen besitzt.
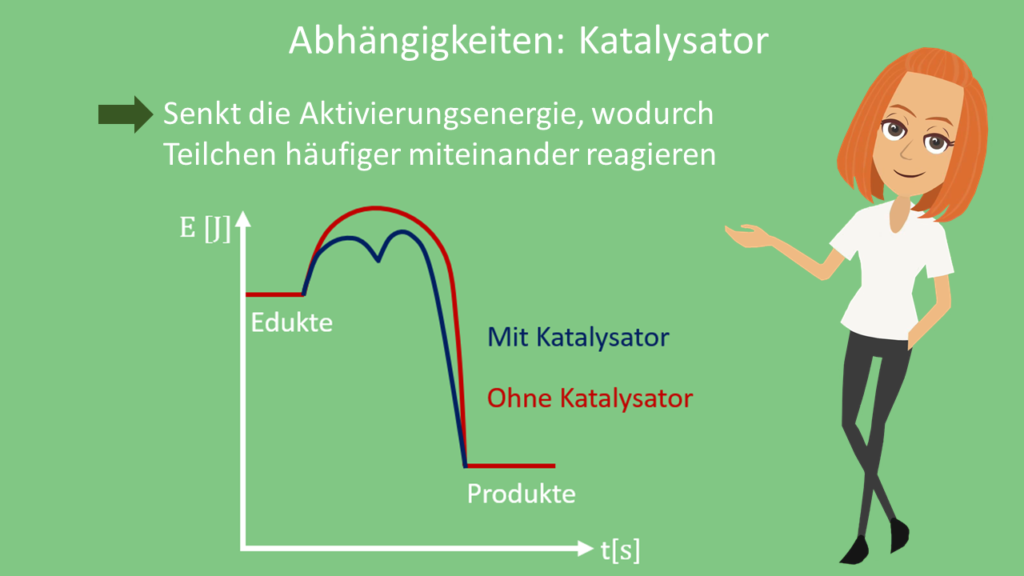
Grundsätzlich kommt eine chemische Reaktion zustande, wenn Teilchen der Ausgangsstoffe zusammenstoßen (= Kollisionstheorie). Dabei müssen sie genug Energie in sich tragen (= Aktivierungsenergie), um zu reagieren.
Mit diesem Wissen lassen sich Reaktionsgeschwindigkeiten beeinflussen.
Reaktionsgeschwindigkeit und Temperatur
Eine Möglichkeit besteht darin, die Temperatur zu erhöhen oder zu erniedrigen. Bei einer höheren Temperatur erhöht sich auch die Geschwindigkeit der Reaktion.
Die Teilchen bewegen sich schneller und stoßen öfter zusammen. Außerdem haben sie eine höhere Eigenenergie, was die Zusammenstöße noch wirksamer macht. Dadurch nimmt die Konzentration der Ausgangsprodukte schneller ab und die der Reaktionsprodukte schneller zu.
Bei einer niedrigeren Temperatur bewegen sich die Teilchen entsprechend langsamer, stoßen seltener zusammen und haben eine geringere Energie.
Reaktionsgeschwindigkeit und Konzentration
Wenn du die Konzentration der Edukte, also die Stoffmenge bei gleichem Volumen erhöhst, steigt ebenfalls die Geschwindigkeit der Reaktion.
Innerhalb des Volumens befinden sich nun mehr Teilchen, die öfter wirksam gegeneinander stoßen können. Dadurch nimmt letztlich die Konzentration der Produkte schneller zu und die Konzentration der Edukte schneller ab.
Weitere Einflussgrößen
Neben der Temperatur und der Konzentration existieren auch noch weitere Einflussgrößen zur Beeinflussung von Reaktionsgeschwindigkeiten.
Eine Möglichkeit besteht darin, einen Katalysator einzusetzen. Dieser ist in der Lage, die Aktivierungsenergie der Edukte zu senken. Dadurch stoßen die Edukte öfter wirksam zusammen und erhöhen so die Reaktionsgeschwindigkeit.
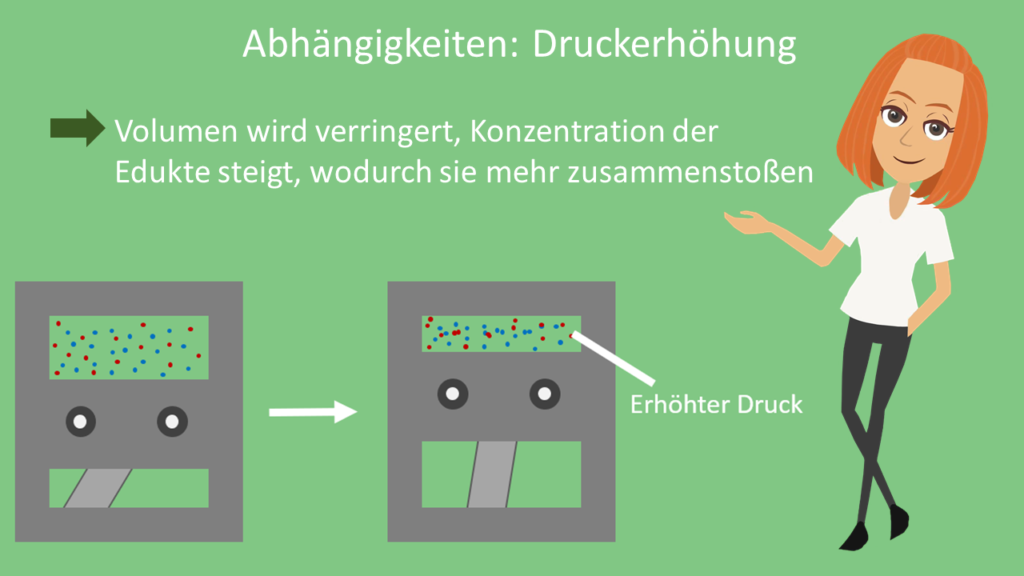
Eine weitere Möglichkeit insbesondere zur Erhöhung der Reaktionsgeschwindigkeiten von Gasen ist die Druckerhöhung. So kannst du beispielsweise das Volumen verringern. Dadurch steigt die Konzentration der Edukte, wodurch sie ebenfalls öfter wirksam zusammenstoßen können.
Auch der sogenannte Zerteilungsgrad kann eine Erhöhung der Reaktionsgeschwindigkeit bewirken. Dieser beschreibt, wie der Name schon sagt, wie stark ein Stoff zerteilt ist. Je granularer er dabei ist, desto größer ist seine Oberfläche. Diese Oberflächenvergrößerung hat zur Folge, dass die Teilchen wahrscheinlicher aufeinander treffen und so die Reaktionsgeschwindigkeit ebenfalls erhöhen können.
Neben bereits genannten Einflussgrößen kann auch der pH Wert die Geschwindigkeit der Reaktion bestimmen. Dies ist insbesondere bei Enzymen der Fall, welche ein begrenztes pH Optimum besitzen und so eine individuelle Enzymaktivität haben.