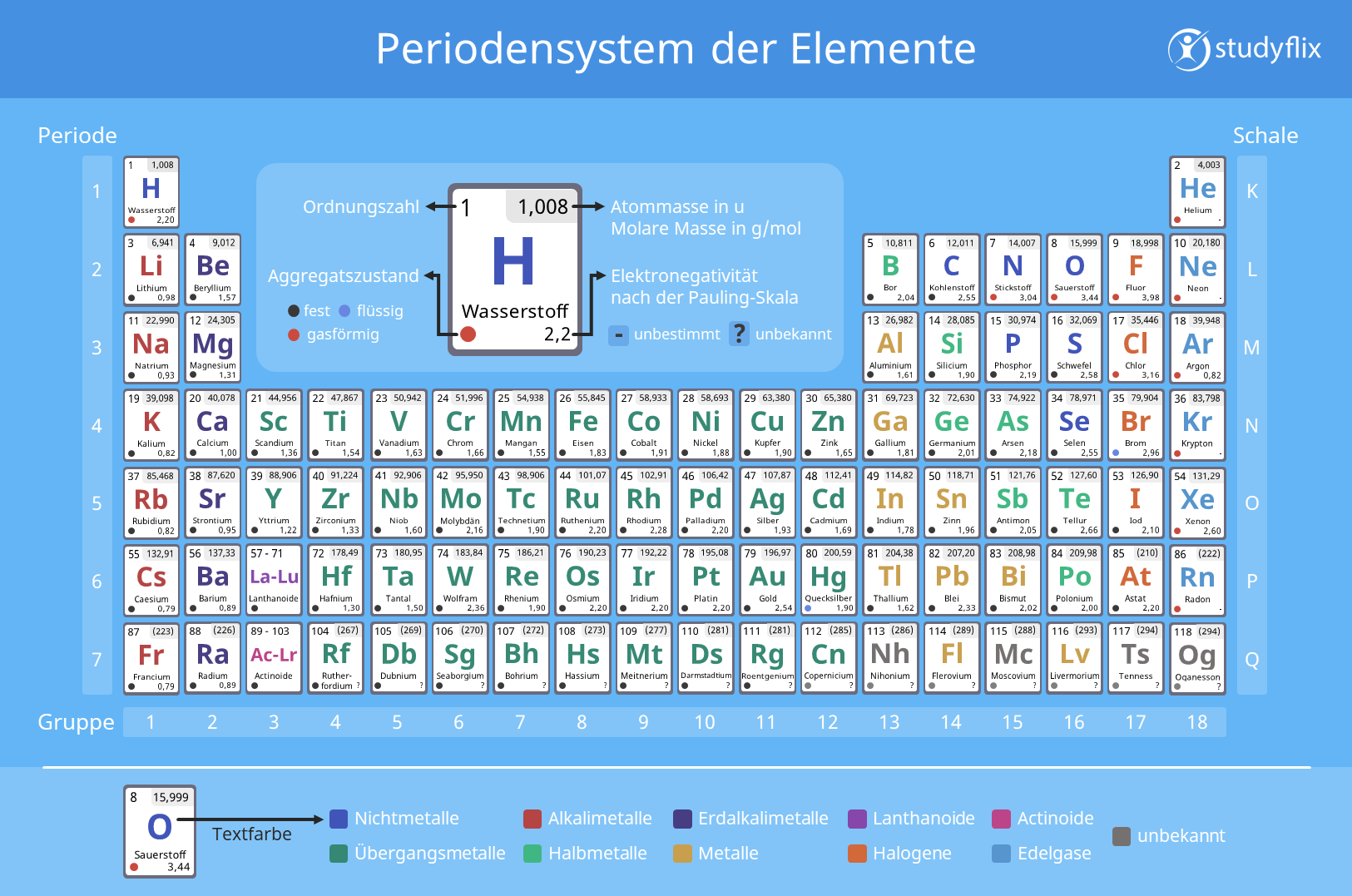
Periodensystem
Das Periodensystem der Elemente ist ein wichtiges Werkzeug in der Chemie. Wie das Periodensystem aufgebaut ist und wie viele Elemente es gibt, erfährst du hier und im Video .
Das Periodensystem der Elemente kannst du dir hier als Datei herunterladen und ausdrucken.
Inhaltsübersicht
Periodensystem einfach erklärt
Das Periodensystem der Elemente (PSE
) ist eine Tabelle, in der alle chemischen Elemente dargestellt sind. Sie sind nach ihrer Ordnungszahl sortiert. Außerdem sind sie in die entsprechenden Zeilen und Spalten eingeordnet.
Es gibt drei wichtige Merkmale des PSE:
- Elemente sind in einem Kästchen links oben durch ihre Ordnungszahl gekennzeichnet
- Elemente sind in Zeilen (=Perioden) und Spalten (=Gruppen) eingeordnet
- Elemente einer Gruppe haben oft ähnliche chemische Eigenschaften
Die Einteilung der chemischen Elemente in Gruppen und Perioden erfolgt nach zwei Hauptkriterien: Atomaufbau und chemische Eigenschaften.
Die Kästchen der Elemente im PSE nennst du auch Elementkarten. Auf ihnen findest du zusätzliche Informationen der Elemente. Zum Beispiel das Elementsymbol. Mit dem Elementsymbol werden die Namen im Periodensystem abgekürzt. Für das erste Element Wasserstoff (Ordnungszahl 1) lautet das Elementsymbol H.
Aufbau des Periodensystems
Grundsätzlich wird das Periodensystem in Perioden und in Gruppen eingeteilt. Die sieben Perioden werden horizontal von oben nach unten angeordnet, die acht Hauptgruppen vertikal von links nach rechts. Zwischen der zweiten und der dritten Hauptgruppe befinden sich noch die zehn Nebengruppen. Die Elemente sind nach ihrer Ordnungszahl geordnet.
Einfach erklärt zeigen wir dir den Aufbau und die Ordnung des Periodensystems in unserem Beitrag dazu.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Ordnungszahl
Die Ordnungszahl der chemischen Elemente teilt dir neben der Stellung im Periodensystem noch weitere Informationen mit. Sie gibt die Anzahl der Protonen in einem Atom an. Protonen sind die positiv geladenen Grundbausteine eines Atoms und befinden sich im Atomkern. Deswegen kannst du statt Ordnungszahl auch den Begriff Kernladungszahl sagen.
Atome, deren Ordnungszahlen übereinstimmen, gehören zum gleichen chemischen Element. Wenn du die Protonenanzahl eines Atoms kennst, findest du mithilfe des Periodensystems schnell heraus, um welches chemische Element es sich handelt.
Neben der Anzahl der positiven Protonen gibt die Ordnungszahl auch an, wie viele negative Elektronen das Atom hat. Demnach sind die Atome elektrisch neutral. Sie haben keine Gesamtladung, da die Anzahl positiver und negativer Ladungen gleich ist. Das Wasserstoffatom mit der Ordnungszahl 1 hat zum Beispiel ein Proton und ein Elektron.
Die Ordnungszahl im Periodensystem steigt innerhalb einer Periode von links nach rechts mit jedem Element um eins. Wenn du am Ende einer Periode angelangt bist, siehst du, dass die Ordnungszahl auf der linken Seite der nächsten Periode weitergezählt wird.
Perioden
Die Zeilen im Periodensystem nennst du auch Perioden. Die sieben Perioden werden von oben nach unten gezählt.
Die Perioden stehen in einem Zusammenhang mit dem Aufbau der Atome im Schalenmodell . In diesem Modell bewegen sich die Elektronen auf sogenannten Schalen. Sie sind ähnlich wie bei einer Zwiebel in Schichten um die Mitte, den Atomkern, angeordnet. Die Anzahl der Schalen eines Atoms hängt von der Anzahl seiner Elektronen ab. Denn jede Schale hat nur für eine begrenzte Anzahl an Elektronen Platz.
Deshalb ist das PSE in Perioden eingeteilt: Ist eine Schale voll, kann sie kein weiteres Elektron mehr aufnehmen. Das bedeutet, dass für ein weiteres Elektron eine neue Schale benötigt wird. Das erklärt den „Sprung“ von der rechten Seite im PSE zum nächsten Element nach links in die nächste Periode. Demnach gibt die Anzahl der Periode auch die Anzahl der Schalen an.
Verteilung der Elektronen
Schauen wir uns zu dem Zusammenhang zwischen Perioden und Schalen ein Beispiel an.
Die erste Periode endet nach dem Element Helium (He) mit der Ordnungszahl 2. Demnach bietet die erste Schale Platz für zwei Elektronen. Du nennst sie auch K-Schale. Die weiteren Schalen benennst du nachfolgend in alphabetischer Reihenfolge.
Die zweite Periode (L-Schale) jedoch hat Raum für acht Elektronen. Das erkennst du daran, dass in der zweiten Periode acht weitere chemische Elemente hinzukommen. Die Periode endet nach dem Element Neon (Ne) mit der Ordnungszahl 10.
Anhand der Zeile des Periodensystems kannst du also ablesen, wie viele Schalen ein Element zur Verteilung seiner Elektronen braucht. Denn die Anzahl der Elemente in einer Periode ändert sich im Verlauf des Periodensystems. Dementsprechend haben Schalen eine unterschiedliche Anzahl von Elektronen, die sie maximal aufnehmen können.
Die vierte Schale zum Beispiel kann mit 18 Elektronen acht Elektronen mehr als die dritte Schale aufnehmen. Denn wie du siehst, kommen in der vierten Periode zehn weitere Elemente hinzu.
Gruppen
Neben den Perioden kannst du im PSE die Elementgruppen in Form von Spalten erkennen. Sie sind von links nach rechts durchnummeriert.
Die insgesamt 18 Spalten sind aufgeteilt in acht Hauptgruppen und zehn Nebengruppen. Die Hauptgruppen sind jedoch von den Nebengruppen unterbrochen. Die ersten beiden Hauptgruppen findest du links im Periodensystem, die restlichen sechs Hauptgruppen auf der rechten Seite.
Elemente einer Gruppe haben oft ähnliche chemische Eigenschaften. Das heißt, dass sie beispielsweise in einer chemischen Reaktion ein vergleichbares Verhalten zeigen. Deswegen haben Hauptgruppen auch häufig einen charakteristischen Namen.
Beispielsweise stammt der Name der Halogene (übersetzt: Salzbildner) daher, dass sie gerne, v. a. mit Metallen, Salze, das heißt ionische Verbindungen (Bsp.: NaCl) bilden.
Zu den wichtigsten Hauptgruppen zählst du die…
- Alkalimetalle : Li, Na, K, Rb, Cs
- Erdalkalimetalle: Be, Mg, Ca, Sr, Ba
- Chalkogene: O, S, Se, Te, Po
- Halogene: F, Cl, Br, I, At
- Edelgase: He, Ne, Ar, Kr, Xe, Rn
Wenn du die Hauptgruppen des Periodensystems sowie deren einzelne Elemente genauer kennenlernen willst, dann schau dir unseren extra Beitrag dazu an. Dort findest du auch Merksätze für die einzelnen Hauptgruppen.
Elementkarte
Jedes chemische Element wird im PSE durch eine sogenannte Elementkarte dargestellt. Je nach Periodensystem geben dir die Elementkarten mehr oder weniger Informationen.
Am Beispiel der Elementkarte von Sauerstoff zeigen wir dir, welche Information du aus einer Elementkarte gewinnen kannst.
Ordnungszahl
Links oben auf einer Elementkarte kannst du die Ordnungszahl des Elements finden. Für Sauerstoff ist es die 8. An ihr kannst du die Anzahl an Protonen und Elektronen im Atom ableiten. Also hat Sauerstoff 8 Protonen und 8 Elektronen.
Elementsymbol
In der Mitte einer Elementkarte und am größten dargestellt, findest du das Elementsymbol. Für Sauerstoff lautet es „O“. Die Elementsymbole leiten sich von den griechischen oder lateinischen Bezeichnungen ab. „O“ ist die Abkürzung für oxygenium.
Atommasse
Rechts oben findest du die Angabe der Atommasse. Sie setzt sich aus dem Gewicht der Protonen und Neutronen im Atomkern zusammen.
Aggregatzustand
Links unten findest du eine farbliche Kennzeichnung. Sie gibt den Aggregatzustand bei Normalbedingungen an. Die meisten chemischen Elemente wie beispielsweise Metalle sind bei Standardbedingungen fest. Sauerstoff hat eine rote Kennzeichnung, da er bei Standardbedingungen gasförmig ist.
Elektronegativität
Rechts unten findest du den Wert für die Elektronegativität . Sie beschreibt, wie stark ein Element die Elektronen einer chemischen Bindung für sich beansprucht. Sauerstoff gehört mit einem Wert von 3,44 zu den elektronegativsten Elementen.
Trends im Periodensystem
Chemische Elemente besitzen Eigenschaften, die sich im Verlauf des Periodensystems verändern. Dabei verändern sie sich einerseits innerhalb einer Periode, das heißt von links nach rechts. Andererseits aber auch innerhalb einer Elementgruppe, das heißt von oben nach unten.
Die Eigenschaften folgen demnach einem bestimmten Trend. Die Trends einiger Eigenschaften sind wichtig für das Verständnis des Periodensystems.
Aufgepasst: Die hier beschriebenen Trends gelten zunächst nur für die Hauptgruppenelemente.
Atomradius
Der Atomradius nimmt innerhalb einer Gruppe von oben nach unten zu. Denn wie du schon weißt, kommt bei jeder weiteren Periode eine neue Elektronenschale hinzu. Die äußersten Elektronen entfernen sich somit immer weiter vom Atomkern und der Radius steigt.
Innerhalb einer Periode von links nach rechts nimmt der Atomradius ab. Die Kernladungszahl steigt zwischen jedem Element um eins, da jedes Mal ein Proton im Atomkern dazukommt. Durch die größere Protonenanzahl werden die Elektronen stärker angezogen als bei dem vorherigen Element und der Atomradius sinkt.
Ionisierungsenergie
Die Ionisierungsenergie ist der Energiebeitrag, der aufgewendet werden muss, um ein Elektron aus der äußersten Schale eines Atoms zu entfernen.
Innerhalb einer Gruppe nimmt die Ionisierungsenergie von oben nach unten ab. Denn durch jede weitere Periode und somit Elektronenschale spüren die äußeren Elektronen eine schwächere Anziehung. Der positive Kern wird durch eine größere Anzahl von Elektronen immer stärker „abgeschirmt“. Deshalb können die äußeren Elektronen mit weniger Energie entfernt werden.
Innerhalb einer Periode von links nach rechts steigt die Ionisierungsenergie. Wie du gelernt hast, steigt die Kernladung bei jedem Element um eins. Die hinzukommenden Elektronen jedoch bewirken keine bessere Abschirmung, da sie alle in der gleichen Schale sitzen.
Elektronegativität
Die Elektronegativität verhält sich im Periodensystem ähnlich zu der Ionisierungsenergie. Innerhalb einer Gruppe von oben nach unten nimmt sie ab. Innerhalb einer Periode nimmt sie von links nach rechts zu. Die höchste Elektronegativität hat das Element Fluor.
Geschichte des Periodensystems
Die ersten Regelmäßigkeiten zwischen verschiedenen chemischen Elementen erkannte Johann Döbereiner im Jahre 1816. Er bildete Dreiergruppen aus Elementen, die ähnliche Eigenschaften zeigten und nannte sie Triaden. Dabei bemerkte er, dass die Differenzen zwischen den Atommassen einer Triade sehr ähnlich waren.
Die Erkenntnis von Döbereiner war eine wichtige Grundlage für das moderne Periodensystem, das wir kennen. Die Chemiker Mendelejew und Meyer arbeiteten beide in den 1860er Jahren stark an einer ersten Version. 1869 stellte Mendelejew seinen ersten Entwurf vor, der ungefähr 60 Elemente beinhaltete.
Seit 1869 wurde das PSE durch den Fortschritt in der Chemie ständig erweitert. Einerseits sind die Lücken in Mendelejews System gefüllt worden. Andererseits hat die intensive Forschung der Chemiker im 20. Jahrhundert viele zusätzliche Elemente hervorgebracht. Der aktuelle Stand des Periodensystems umfasst 118 Elemente.
Periodensystem zum Ausdrucken
Wenn du das Periodensystem immer griffbereit haben möchtest, kannst du es hier als Datei herunterladen und ausdrucken.
Chemisches Element
Wie du jetzt sicher weißt, bietet dir das Periodensystem eine gute Übersicht der Elemente. Wenn du mehr über chemische Elemente wissen musst, schaue dir jetzt unser Video dazu an!