Atomaufbau
Was ist der Atomaufbau und wie sind deine Teilchen im Atom überhaupt angeordnet? Das erklären wir dir in dem folgenden Beitrag.
Um das Thema noch schneller zu verstehen, kannst du dir gerne unser Video dazu anschauen!
Inhaltsübersicht
Atomaufbau einfach erklärt
Im Atomaufbau oder auch Atombau solltest du dir die drei Begriffe Protonen , Neutronen und Elektronen schon mal gut merken. Früher hatte man sich lange darüber beschäftigt, wie denn Protonen, Neutronen und Elektronen tatsächlich im Atom angeordnet sind. Die Protonen und Neutronen befinden sich dabei im Kern. Die Elektronen kreisen hierbei um den Kern, stellen also die Atomhülle dar.
Der Atomaufbau beschreibt die Anordnung von Protonen, Neutronen und Elektronen in einem Atom.
Heute ist das aktuellste Modell das Orbitalmodell . Das Orbitalmodell beschreibt den tatsächlichen Atomaufbau am besten. Aber auch das Schalenmodell benutzt du vielfach für beispielsweise der Erklärung für die Absorption von Licht.
Atomaufbau Kern
Aber gucken wir uns zusammen erstmal den Atomaufbau des Atomkerns an. Der Atomkern besteht aus Protonen und Neutronen. Zudem ist der Kern wesentlich kleiner die Atomhülle , in der sich die Elektronen befinden. Jedoch befindet sich in deinem Atomkern fast 99,9 % der Gesamtmasse vom Atom.
Schauen wir uns erst einmal die Massen der Kernbausteine an. Die Masse eines Protons beträgt  . Die Masse eines Neutrons ist mit
. Die Masse eines Neutrons ist mit 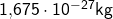 nur unwesentlich höher. Allerdings beträgt die Masse eines Elektrons gerade mal
nur unwesentlich höher. Allerdings beträgt die Masse eines Elektrons gerade mal  . Daher ist es nicht verwunderlich, dass der Atomkern eine wesentlich höhere Masse besitzt.
. Daher ist es nicht verwunderlich, dass der Atomkern eine wesentlich höhere Masse besitzt.
Möchtest du mehr Information zum Atomaufbau des Kerns oder zum Atom haben, dann schau dir unser Video zum Atom an.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Atomaufbau Atomhülle
Schauen wir uns jetzt die Atomhülle ein bisschen genauer an. Die Atomhülle besteht aus Elektronen, die um den Atomkern kreisen. Deine Elektronen kreisen jetzt nicht, wie früher gedacht wurde, willkürlich um den Kern. Sie kreisen vielmehr in bestimmten Räumen, sogenannten Orbitalen um deinen Atomkern. Es gibt sehr viele Modelle, die den Atombau der Atomhülle beschreiben. Viele davon sind veraltet und entsprechen lange nicht mehr dem heutigen wissenschaftlichen Stand. Die Modelle, die heute zeitgemäß sind und Realität am besten beschreiben, sind das Schalenmodell und das Orbitalmodell.
Atomaufbau Schalenmodell
Im Atomaufbau nach dem Schalenmodell bewegen sich die Elektronen auf kreisförmigen, ebenen Schalen um den Atomkern. Die Schalen befinden sich in diskreten, also festen Abständen voneinander. Dein Atomkern befindet sich im Zentrum aller Schalen.
Die Schalen kannst du mit Elektronen besetzen. Die innerste Schale, auch K-Schale genannt, hat Platz für zwei Elektronen ( ). Die weiteren Schalen benennst du nach dem nächstkommenden Buchstaben im Alphabet. Somit ist die zweite Schale die L-Schale. Die L-Schale besetzt du mit acht Elektronen (
). Die weiteren Schalen benennst du nach dem nächstkommenden Buchstaben im Alphabet. Somit ist die zweite Schale die L-Schale. Die L-Schale besetzt du mit acht Elektronen (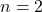 ). Möchtest du wissen wie viele Elektronen in die weiteren Schalen passen so gibt es eine Formel dafür.
). Möchtest du wissen wie viele Elektronen in die weiteren Schalen passen so gibt es eine Formel dafür.

Dein  bezeichnet die Anzahl der Elektronen in der jeweiligen Schale und dein
bezeichnet die Anzahl der Elektronen in der jeweiligen Schale und dein  bezeichnet jeweilige Schale. Für die Schale, die am nächsten am Atomkern liegt, gilt
bezeichnet jeweilige Schale. Für die Schale, die am nächsten am Atomkern liegt, gilt  .
.
Jede Schale besitzt zudem ein eigenes Energieniveau. Sind Elektronen in einer Schale, die näher am Kern ist, so hast du ein geringes Energieniveau. Der Atomaufbau nach dem Schalenmodell erlaubt dir somit auch ein Übergang der Elektronen zwischen den einzelnen Schalen. Geht ein Elektron von einer Schale mit höherem in eins mit niedrigerem Energieniveau über, so wird Energie frei. Anders herum musst du Energie aufwenden, um ein Elektron von einer Schale mit niedrigem Energieniveau in eine Schale mit höherem Energieniveau zu bringen.
Du solltest dieses Konzept gut verinnerlichen, da die Energie beim Schalenübergang von höhererliegenden zur tieferliegenden Schale wichtige Vorgänge in der Realität beschreibt. Beispielsweise beruhen sehr viele Vorgänge, die mit Aussendung von Licht zu tun haben, auf diesem Konzept.
Das Schalenmodell und den Unterscheid zum Bohrschen Atommodell erklären wir dir ausführlich in diesem Video.
Atomaufbau Orbitalmodell
Schauen wir uns jetzt das Orbitalmodell, also das aktuellste Modell vom Atomaufbau an. Ein Orbital beschreibt die Verteilung deiner Elektronen im Atom. Du kannst dir das Orbital auch vereinfacht als Aufenthaltsbereich eines Elektrons vorstellen. Das Orbital entsteht mathematisch aus dem Betragsquadrat der Wellenfunktion. Die Wellenfunktion enthält dabei sämtliche Informationen über das Atom.
Du kannst nun deine Orbitale auch graphisch darstellen. Wichtig sind erst einmal das s– und das p-Orbital. Das s-Orbital ist kugelförmig und das p-Orbital ist hantelförmig.
Quantenzahlen Atombau
Im Orbitalmodell beschreibst du die Energiezustände deiner Elektronen mit den Quantenzahlen und ist wichtig für deinen Atomaufbau. Dabei gibt es vier Quantenzahlen. Du hast somit für jeden Zustand deines Elektrons eine eindeutige Definition.
Die Hauptquantenzahl n gibt dir die Orbitalgröße an. Hierbei nimmt die Hauptquantenzahl die Werte (1, 2, 3, …, n) an.
Die Nebenquantenzahl l gibt dir deine Orbitalgestalt an. Deine Nebenquantenzahl kann die Werte (0, 1, 2, …, n-1) annehmen.
Deine Magnetquantenzahl m gibt dir die Orientierung des Orbitals im Raum an. Die Nebenquantenzahl kann die Werte (-l, …, 0, …, +l) annehmen.
Mit der Spinquantenzahl s bekommt dein Elektron auch einen Drehsinn. Dein Elektron hat einen Spin, kann sich also in entweder in einer parallelen Richtung oder in entgegengesetzter Richtung drehen. Dein Spin nimmt entweder den Wert + 1/2 oder -1/2 an.
Schauen wir uns jetzt das Aussehen der Orbitale an. Dein Orbital wird mit zunehmendem n größer. Nimmt dein l zu, so ändert sich auch deine Orbitalgestalt. Beispielsweise ist das s-Orbital für n = 1 durch l = 0 (1s) und das p-Orbital für n = 2 durch l = 1 (2p) beschrieben. Dein m verändert deine Ausrichtung der Orbitale im Raum, wie du an den Orbitalen für l = 1 siehst. Für m = 0 ist dein p-Orbital beispielsweise horizontal, für m = 1 und m = -1 waagerecht ausgerichtet.
Pauli Prinzip Atombau
Das Pauli Prinzip sagt dir, dass zwei Elektronen nicht in allen vier Quantenzahlen übereinstimmen dürfen. Dafür ist auch deine Spinquantenzahl da, die dir die Unterscheidung der Quantenzahlen mit + 1/2 und – 1/2 gibt.


