Elektrolyse Anwendungsgebiete
Die Elektrolyse findet insbesondere für verschiedenste technische Stofftrennungen Anwendung. Doch auch zur Metallbearbeitung und Abwasserreinigung kann sie verwendet werden. Nachfolgend beschreiben wir dir drei wichtige Anwendungsbereiche der Elektrolyse.
Inhaltsübersicht
Chloralkalielektrolyse
Mit der Chloralkalielektrolyse kannst du aus einer wässrigen Lösung von Natriumchlorid die Produkte Chlor, Wasserstoff und Natronlauge erzeugen. Du kannst dabei zwischen drei technischen Verfahren unterscheiden:
Beim Diaphragmaverfahren werden der Kathoden- und der Anodenraum durch ein Diaphragma aus Asbest getrennt. Die Kathode besteht meist aus Stahl und die Anode aus beschichtetem Titan. Die Anoden- und Kathodenreaktionen setzen sich wie folgt zusammen:
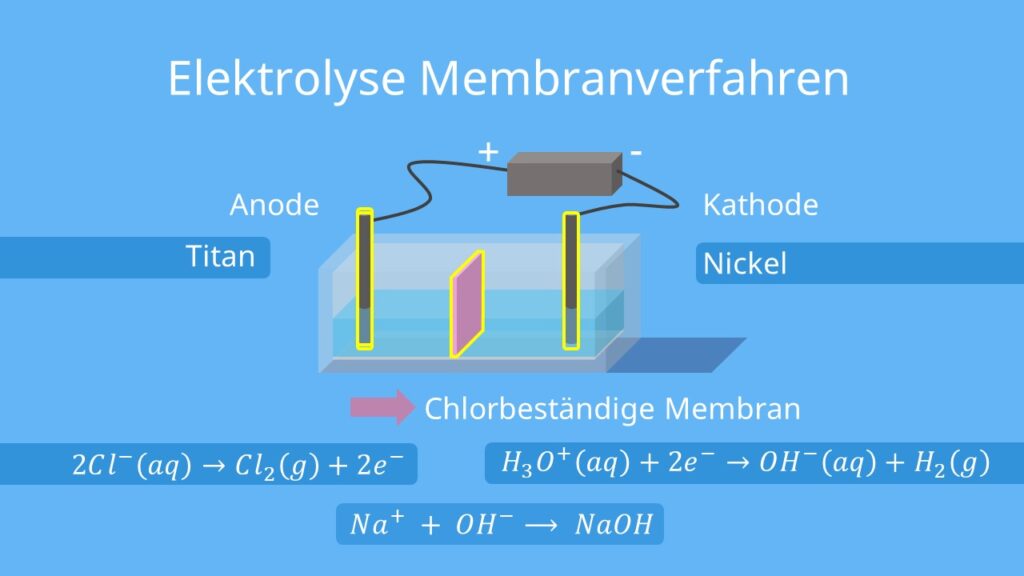
Anode: 2Cl–(aq) -> Cl2 (g) +2e–
Kathode: 2 H3O+(aq) + 2e– -> OH–(aq) + H2(g)
Die freien Natriumionen (Na+) bilden zusammen mit den entstandenen Hydroxidionen (OH–) Natronlauge (NaOH) bis zu einer Konzentration von ca. 15%.
Die zweite Methode ist das sogenannte Membranverfahren. Hierbei wird das Diaphragma durch eine dünne chlorbeständige Membran ersetzt. Wie beim Diaphragmaverfahren besteht die Anode aus Titan, die Kathode jedoch aus Nickel. Die chemischen Reaktionen entsprechen denen des Diaphragmaverfahrens.
Als dritte und letzte Methode zur Chloralkalielektrolyse kannst du das Amalgamverfahren verwenden. Dieses besteht aus einer Titan-Anode und einer Quecksilber-Kathode. Das an der Kathode gebildete Natrium löst sich in dem Quecksilber als Natriumamalgam auf. Durch diese Reaktion erhält das Amalgamverfahren auch seinen Namen.
Theoretisch können folgende Elektrodenreaktionen ablaufen:
Anode:
2 Cl–(aq) -> Cl2(g) + 2e–
4 OH–(aq) -> O2(g) + 2 H2O +4e–
Kathode:
Na+(aq) + e– -> Na
2 H3O+(aq) + 2e– -> H2 + 2 H2O
Das Natrium reagiert an der Quecksilber-Kathode sofort zu Natriumamalgam.
Na/Hgx
Wenn du nun Natronlauge aus der Reaktion erhalten willst, dann muss dein Natriumamalgam in einer weiteren Kammer, dem Amalgamzersetzer, zur Reaktion gebracht werden. Durch die Reaktion mit Wasser zersetzt sich das Natrumamalgan zu Natronlauge:
2 Na/Hgx + 2 H2O -> 2 NaOH(aq) + H2(g)
Als Gesamtreaktion erhältst du:
2 NaCl(aq) + 2 H2O -> 2 NaOH(aq) + Cl2(g) + H2(g)
Kolbe Elektrolyse
Bei der Kolbe Elektrolyse werden Carbonsäuren oder dessen Salze (Carboxylate) gespalten. Ziel dieser Reaktion ist es, zwei Reste aneinander zu kuppeln. Zuerst entstehen dabei Radikale, die dann zu verschiedenen Kohlenwasserstoffen weiterreagieren können. So konnte der Entdecker der Reaktion Herrmann Kolbe beispielsweise aus Essigsäure Ethan herstellen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Galvanik
In der Galvanik, oder auch Galvanotechnik, wird die Elektrolyse zur Abscheidung von Metallen verwendet. Da die Qualität eines Werkstücks oft von seinem metallischen Glanz abhängig ist, ist die Effektivität der Elektrolyse hier besonders wichtig.
Galvanische Zelle
Du hast nun einige Anwendungen der Elektrolyse kennengelernt. Dabei kannst du durch Strom eine chemische Reaktion erzwingen. Allerdings können chemische Reaktionen in galvanischen Zellen auch umgekehrt Strom liefern. Schau dir jetzt unseren Beitrag an, um mehr darüber zu erfahren!