Wärmeenergie
Wenn du schon einmal Wasser gekocht hast, dann bist du mit der Wärmeenergie in Kontakt gekommen. Das ist die Energie, die unter anderem dein Wasser zum Kochen bringt. In diesem Beitrag wollen wir die die Wärmeenergie näher bringen.
Du möchtest ganz entspannt lernen? Dann schaue dir jetzt unser Video zum Thema Wärmeenergie an! Hier bekommst du alles was du wissen musst in nur wenigen Minuten perfekt aufbereitet.
Inhaltsübersicht
Wärmeenergie einfach erklärt
Die Wärmeenergie (auch thermische Energie) ist ein Teil der inneren Energie eines Systems und beschreibt die Energie, die in der ungeordneten Bewegung der mikroskopischen Bestandteile des Systems (Atome, Moleküle) steckt.
In manchen Fällen wird die Wärmeenergie mit den Begriffen Wärme , Temperatur, innere Energie oder Wärmemenge gleichgesetzt. Der entsprechende Kontext, in dem der Begriff Wärmeenergie auftaucht, sollte mögliche Mehrdeutigkeiten vermeiden.
Wird die Erwärmung eines Körpers betrachtet, so findet man die Wärmeenergie (oder Wärmemenge) im Zusammenhang mit der Wärmekapazität des Körpers folgendermaßen vor
 .
.
Hier steht  für die Wärmeenergie in
für die Wärmeenergie in  ,
,  für die Wärmekapazität in
für die Wärmekapazität in  ,
,  für die Masse des Körpers und
für die Masse des Körpers und  für die gewünschte Temperaturänderung in
für die gewünschte Temperaturänderung in  . Vereinzelnd findest du statt dem
. Vereinzelnd findest du statt dem  ein
ein  vor.
vor.
Wärmeenergie Formel
In diesem Abschnitt wollen wir uns die wichtigsten Formeln anschauen, die im Zusammenhang mit der Wärmeenergie auftreten. Du wirst auch etwas über die Verknüpfung mit der Änderung der inneren Energie und dem idealen Gas erfahren.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Wärmekapazität
Wenn du einem Körper Wärme zuführst, dann ändert sich seine Temperatur. Wie stark die Temperaturänderung ist, hängt von verschiedenen Faktoren ab. Du kannst dir leicht vorstellen, dass du mehr Energie benötigst, umso mehr Wasser du zum Beispiel erwärmen möchtest. Nehmen wir eine gleiche Menge an Wasser und Milch, dann benötigen wir zum Erreichen der gleichen Temperatur unterschiedlich viel Energie in Form von Wärme. Wir haben hier zum Vergleich Milch genommen, da diese eine andere Wärmekapazität  als Wasser besitzt und wir daher nach der Formel im vorherigen Abschnitt eine andere Energiemenge erwarten. Diese zwei Beobachtungen können wir in folgender Formel festhalten
als Wasser besitzt und wir daher nach der Formel im vorherigen Abschnitt eine andere Energiemenge erwarten. Diese zwei Beobachtungen können wir in folgender Formel festhalten
 .
.
Du solltest bei dieser Formel aber darauf achten, welche Bedeutung die Wärmekapazität hat. Der Begriff Kapazität ist unglücklich gewählt worden, denn er könnte die falsche Vorstellung hervorrufen, dass es sich bei der Wärmeenergie  um die Energie handelt, die der Körper aufnehmen kann. Tatsächlich ist aber
um die Energie handelt, die der Körper aufnehmen kann. Tatsächlich ist aber  nicht mehr als diejenige Energie, die notwendig ist, um die Temperatur eines bestimmten Körpers um den Betrag
nicht mehr als diejenige Energie, die notwendig ist, um die Temperatur eines bestimmten Körpers um den Betrag  zu ändern.
zu ändern.
Zusammenhang zur inneren Energie
Wie im ersten Abschnitt erwähnt wurde, ist die Wärmeenergie ein Teil der inneren Energie eines Systems. Der Zusammenhang zwischen innerer Energie  und Wärmeenergie
und Wärmeenergie  wird durch den 1. Hauptsatz der Thermodynamik
gegeben und lautet
wird durch den 1. Hauptsatz der Thermodynamik
gegeben und lautet
 .
.
Hier beschreibt  die Änderung der inneren Energie eines Systems, wenn es von einem Zustand 1 in einen Zustand 2 übergeht. Dieser Übergang kann durch die Zu- oder Abfuhr von Wärmeenergie
die Änderung der inneren Energie eines Systems, wenn es von einem Zustand 1 in einen Zustand 2 übergeht. Dieser Übergang kann durch die Zu- oder Abfuhr von Wärmeenergie  , durch die Verrichtung von Arbeit
, durch die Verrichtung von Arbeit
 oder beidem stattfinden.
oder beidem stattfinden.
Es ist wichtig, sich den Unterschied zwischen Wärme, Temperatur und innerer Energie bewusst zu machen. Wärme beschreibt einen Prozess, die Übertragung von Energie von einem System auf ein anderes aufgrund einer Temperaturdifferenz. Die Wärme ist also keine Zustandsgröße . Im Gegensatz dazu sind die Temperatur und die innere Energie Zustandsgrößen. Die Temperatur beschreibt die mittlere kinetische Energie der Atome oder Moleküle eines Systems. Die innere Energie gibt hingegen Auskunft über die Gesamtenergie eines Systems.
Ideales Gas
Im Fall des idealen Gases kann man tatsächlich die thermische Energie mit der Temperatur gleichsetzen. Für das ideale Gas gilt
 .
.
Hier steht  für die Boltzmann-Konstante
in
für die Boltzmann-Konstante
in  ,
,  für die Temperatur in
für die Temperatur in  ,
,  für die Anzahl an Teilchen im Gas,
für die Anzahl an Teilchen im Gas,  für die Freiheitsgrade der Teilchen,
für die Freiheitsgrade der Teilchen,  für die Gaskonstante in
für die Gaskonstante in  und
und  für die Stoffmenge in Mol
. Für weitere Details zu dieser Formel, kannst du dir gerne unseren Beitrag zur inneren Energie anschauen.
für die Stoffmenge in Mol
. Für weitere Details zu dieser Formel, kannst du dir gerne unseren Beitrag zur inneren Energie anschauen.
Wärmekapazität von Wasser
| Stoff | Wärmekapazität in  |
| Aluminium | 900 |
| Kupfer | 390 |
| Glas | 840 |
| Eisen | 450 |
| Silber | 230 |
| Holz | 1700 |
| Wasser (flüssig) | 4186 |
| Protein | 1700 |
Stell dir vor, du hast 20 kg Wasser und möchtest das von  auf
auf 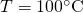 erwärmen. Welche Wärmeenergie ist dafür notwendig? Damit wir diese Energie berechnen können, brauchen wir die spezifische Wärmekapazität des Wassers. Aus der obigen Tabelle entnehmen wir, dass Wasser im flüssigen Zustand eine Wärmekapazität von
erwärmen. Welche Wärmeenergie ist dafür notwendig? Damit wir diese Energie berechnen können, brauchen wir die spezifische Wärmekapazität des Wassers. Aus der obigen Tabelle entnehmen wir, dass Wasser im flüssigen Zustand eine Wärmekapazität von  besitzt. Die Temperaturänderung
besitzt. Die Temperaturänderung  ist in diesem Fall
ist in diesem Fall  oder in Kelvin
oder in Kelvin  . Mit diesen Daten können wir die benötigte Wärmeenergie berechnen zu
. Mit diesen Daten können wir die benötigte Wärmeenergie berechnen zu
 .
.
Temperatur eines idealen Gases
Nehmen wir an, dass wir einen Mol eines idealen Gas haben und uns nur für die Translationsbewegungen der einzelnen Moleküle interessieren. Bei welcher Temperatur in Kelvin besitzt das Gas eine thermische Energie von 4150  ? Da wir es hier mit einem idealen Gas zu tun haben, können wir die Formel
? Da wir es hier mit einem idealen Gas zu tun haben, können wir die Formel

verwenden. Wenn wir diese nach der Temperatur umstellen, erhalten wir
 .
.
Setzen wir nun noch  (da sich die Moleküle in drei Richtungen unabhängig bewegen können),
(da sich die Moleküle in drei Richtungen unabhängig bewegen können), 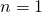 und
und  ein, so bekommen wir eine Temperatur von
ein, so bekommen wir eine Temperatur von
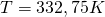 .
.
