Zustandsdiagramm Werkstoffkunde
Nachdem du dich mit Defekten jetzt auskennst, wollen wir uns als nächstes dem Zustandsdiagramm, oder auch Phasendiagramm allgemein zuwenden. Was Phasen sind, hast du ja schon im Video zu Flächendefekten gelernt. Zur Erinnerung zeigen wir dir hier noch einmal die Definition: Unter einer Phase versteht man eine unterschiedliche Anordnung bei gleicher chemischer Struktur. Diese Phasen können in einem solchen Zustandsdiagramm am Beispiel von einem oder mehreren Stoffen analysiert werden. Das Phasendiagramm von Wasser ist ein typisches Beispiel von einem Einstoffsystem. In unserem Video lernst du, was es mit einem Zustands- oder Phasendiagramm von zwei Stoffen auf sich hat und wie du dieses richtig liest.
Inhaltsübersicht
Phasendiagramm Legierung
Bei dieser Art der Zustandsdiagramme in der Werkstoffkunde wird durch eine Variation der Temperatur, das Verhalten einer Stoffmischung aus zwei Komponenten analysiert. Dabei kann es je nach Löslichkeit der verschiedenen Bindungspartner untereinander, unterschiedliche Besonderheiten in einem Phasendiagramm geben.
Auf der y-Achse wird die Temperatur und auf der x-Achse der Anteil der jeweiligen Atome aufgezeichnet. Links auf der horizontalen Achse wird 100% von Atomsorte A und auf der rechten Seite 100% von Atomsorte B eingetragen. Diese Werte nehmen dann in der jeweils entgegengesetzten Richtung ab. So steht ganz links ein 0% Anteil von Atomsorte B und ganz rechts 0% Anteile von Atomsorte A.
Bei Zustandsdiagrammen der Werkstoffkunde geht es hauptsächlich darum, den Anteil der verschiedenen Atomsorten in den unterschiedlichen Phasen zu bestimmen. Der Anteil ist wiederum abhängig von der Konzentration der Bindungselemente und der Temperatur des Stoffsystems.
Um ein einfaches Phasendiagramm zu zeigen, wird beispielhaft die Legierung aus Kupfer und Nickel betrachtet. Mit Hilfe dieses Zustandsdiagramms kann dann die Phase und die jeweiligen Anteile der Atomsorten bestimmt werden. Am linken Rand befindet sich hier reines Nickel und am rechten reines Kupfer. Auffällig am Diagramm sind die drei voneinander abgetrennten Bereiche, aber Vorsicht denn es handelt sich hier nicht um drei verschiedene Bereiche.
Der obere Bereich wird flüssige Phase genannt und mit L bezeichnet. Das kannst du dir auch ganz leicht merken, denn je höher die Temperatur desto eher beginnt ein Stoff zu schmelzen und ist somit flüssig.
Unten siehst du die feste Phase Alpha  . Diese befindet sich entsprechend in den tieferen Temperaturbereichen. Der Teil zwischen Alpha und L ist eine sogenannte Mischphase und wird nach unten abgegrenzt durch die Soliduslinie (Solidus) und nach oben durch die Liquiduslinie (Liquidus). Würde man die x-Achsen noch weiter erhöhen, könnten wir irgendwann die Gasphase erkennen.
. Diese befindet sich entsprechend in den tieferen Temperaturbereichen. Der Teil zwischen Alpha und L ist eine sogenannte Mischphase und wird nach unten abgegrenzt durch die Soliduslinie (Solidus) und nach oben durch die Liquiduslinie (Liquidus). Würde man die x-Achsen noch weiter erhöhen, könnten wir irgendwann die Gasphase erkennen.
In dem Zustandsdiagramm der Werkstoffkunde kann man sehr leicht den Zustand von dem Kupfer (Cu) Nickel (Ni) Gemisch bei 1200°C und einem Nickel-Anteil von 60% ablesen. Bei diesen Koordinaten sind die Bindungspartner zusammen in einem festen Zustand, der sich Alpha-Phase nennt, vorhanden. Wenn der Nickel-Anteil auf 20% sinkt, so wandelt sich die Zusammensetzung in eine flüssige Phase um. Dieser Unterschied hängt mit den chemischen Eigenschaften der jeweiligen Bindungspartner zusammen. So kannst du Materialien hitzebeständiger machen, indem du den Anteil einer bestimmten Komponente erhöhst.
Die Cu-Ni Legierung bildet ein eher einfacheres Zustandsdiagramm in der Werkstoffkunde, da die Elemente ineinander vollständig löslich sind. Etwas schwieriger wird es bei den Phasendiagrammen mit Eutektikum und Peritektikum. Hier sind die Bindungspartner nicht mehr in jeder Phase vollständig ineinander lösbar und bilden Besonderheiten.
Eutektikum und Peritektikum
Es gibt auch viele komplexe Zustandsdiagramme in der Werkstoffkunde. Die bekanntesten sind Diagramme mit Eutektikum oder mit Peritektikum, genauso wie eutektoide und peritektoide Phasendiagramme.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Eutektikum
In dieser Art des Phasendiagramms kommt es zu einem sogenannten Eutektikum. Dabei handelt es sich um eine besondere Form der Phase zwischen zwei Bindungspartnern. Die Partner sind im flüssigen Zustand vollständig ineinander löslich. Wird dann die Temperatur gesenkt sind diese überhaupt nicht mehr oder nur teilweise miteinander löslich. Sie zerfallen in ein Kristallgemisch, welches als Eutektikum bezeichnet wird. Dieses besondere Gemisch befindet sich bei der Phase  .
.
Falls die Atomsorten A und B ein solches Eutektikum erzeugen können, haben sie einen eindeutig definierten Schmelzpunkt, den man auch als eutektischen Punkt bezeichnet. Dieser befindet sich am Berührungspunkt von Solidus- und Liquiduslinie. Hier sind alle drei Phasen des Systems im thermodynamischen Gleichgewicht miteinander. Die drei Zustände sind, die Phase der Sorte A ( ), die der Atomsorte B (
), die der Atomsorte B ( ) und die Schmelze (L).
) und die Schmelze (L).
Eutektoid
Bei einem Eutektikum geht es um den Phasenübergang zwischen flüssig und fest. Hingegen handelt es sich bei einem Eutektoid um einen Übergang zwischen einer festen Phase in zwei weitere feste Zustände. Solch ein Zusammenhang gibt es bei dem Eisen-Kohlenstoff-Gemisch. Hier wäre das, bei Senkung der Temperatur, der Übergang zu Perlit.
Das nachfolgende Zustandsdiagramm zeigt eine eutektoide Reaktion der Bindungspartner A und B. Im Prinzip sieht dieses Diagramm dem oberen mit Eutektikum sehr ähnlich. Der Unterschied liegt im Fehlen der Schmelzphase L. Die Bindungspartner befinden sich oberhalb des eutektoiden Punktes in einer festen Phase. Wird jetzt die Temperatur gesenkt, gehen die Partner über den eutektoiden Gleichgewichtspunkt in die Mischpase  über. Hier handelt es sich wieder um das vorher besprochene Eutektikum.
über. Hier handelt es sich wieder um das vorher besprochene Eutektikum.
Peritektikum
Bei einem System mit Peritektikum gibt es kein Minimum in der Liquiduslinie. Es geht hier um den Übergang der Phase der Schmelze L und einer festen Phase  in eine andere, zur
in eine andere, zur  -Phase verschiedene, feste Phase
-Phase verschiedene, feste Phase  .
.
Die waagrechte Linie unter der L +  Phase wird Peritektikale genannt. Auf ihr liegt der sogenannte peritektischer Punkt, bei dem sich die Phasen L +
Phase wird Peritektikale genannt. Auf ihr liegt der sogenannte peritektischer Punkt, bei dem sich die Phasen L +  und
und  im Gleichgewicht befinden.
im Gleichgewicht befinden.
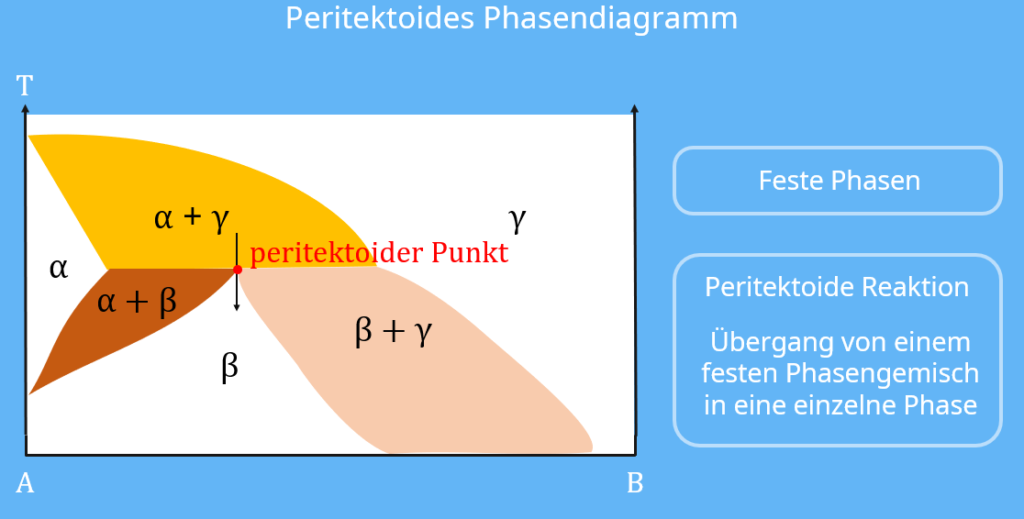
Peritektoid
Bei einem peritektoiden Phasenübergang handelt es sich ungefähr um denselben Übergang, wie bei dem Peritektikum. Allerdings spricht man von einem Peritektoid, wenn alle beteiligten Phasen im festen Zustand vorhanden sind. Somit setzen sich hier zwei feste Phasen in eine dritte feste Phase um.
Der Unterschied zum Zustandsdiagramm Peritektikum liegt wiederum im Fehlen der Schmelzphase L. Die einzelnen Zustände existieren hier nur in der festen Phase.
Merke: alle Diagramme mit „-oide“ betrachten nur feste Phasen!