Ostwald Verfahren
Warum ist das Ostwald Verfahren so wichtig? Neben der Erklärung des Ostwald Verfahrens, zeigen wir dir auch, weshalb es für uns unabdingbar ist. Darüber hinaus betrachten wir die einzelnen Prozessschritte des Verfahrens genauer, wie genau aus Ammoniak dann Salpetersäure hergestellt wird.
Falls du das ganze lieber kompakt zusammengefasst in Video-Form anschauen möchtest, dann empfehlen wir dir unser Video dazu!
Inhaltsübersicht
Ostwald Verfahren einfach erklärt
Das Ostwald Verfahren (auch oft gesucht als: Ostwaldverfahren) ist ein weiterer Schritt in der Verarbeitung des Ammoniaks ( ).
).
 ) weiter zu oxidieren, wobei man Platin als Katalysator benutzt.
) weiter zu oxidieren, wobei man Platin als Katalysator benutzt.Dieses kannst du dann weiter verwenden zur Produktion weiterer wichtiger Chemikalien, wie Ammoniumnitrat ( ).
).
Ostwald Verfahren Geschichte
Das Verfahren ist noch nicht besonders alt und geht zurück auf den Anfang des 20 Jh. . Damals war die Herstellung von effektivem Dünger für die Landwirtschaft noch sehr teuer, da der Grundstoff Chilesalpeter war. Diesen hatte man damals noch mit Schiffen aus Südamerika nach Europa importieren müssen, um ihn dort weiter zu verarbeiten. Dieses Bedürfnis nach billigem Dünger befeuerte die Entwicklung von Prozessen, die als Ziel hatten, das wertvolle Ammoniumnitrat herzustellen. Das Ostwald Verfahren, benannt nach seinem Erfinder Wilhelm Ostwald, stellt dir dabei nur das Zwischenprodukt Salpetersäure ( ) zur Verfügung. Die Ausgangschemikalie Ammoniak (
) zur Verfügung. Die Ausgangschemikalie Ammoniak ( ) beziehst du hier aus dem Haber Bosch Verfahren
. Wenn du mehr zum Haber Bosch Verfahren wissen möchtest, dann klicke doch hier.
) beziehst du hier aus dem Haber Bosch Verfahren
. Wenn du mehr zum Haber Bosch Verfahren wissen möchtest, dann klicke doch hier.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Ostwald Verfahren: Umsetzung von Ammoniak zu NO
Den ersten Schritt des Ostwald Verfahrens stellt dabei die Umsetzung des Ammoniaks aus dem Haber Bosch Verfahren dar. Dabei reagiert das Ammoniak mit dem Sauerstoff in einer Oxidation zu Stickstoffmonooxid ( ):
):
-III +II

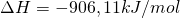
Die Reaktionstemperatur ist hierbei zwischen 800-900°C. Der Grund hierfür liegt darin, dass NO nicht das stabilste Produkt bei der Umsetzung von Ammoniak mit Sauerstoff ist. Es können weiterhin auch noch folgende Nebenreaktionen auftreten:
1. Oxidation zu elementarem Stickstoff:
-III 0

2. Bildung von Lachgas ( ):
):
-III +I

Beide Reaktionen sind deutlich exothermer als die gewünschte Reaktion zu Stickstoffmonooxid, daher können die Nebenreaktionen nach dem Prinzip von Le Chatelier durch eine Erhöhung der Reaktionstemperatur deutlich stärker zurückgedrängt werden als die Reaktion zu  .
.
Des Weiteren wird in der Reaktion ein Platin-Rhodium Katalysator verwendet, der die Reaktion zu Stickstoffmonoxid begünstigt. Allerdings wird das Gasgemisch aus  und
und  möglichst schnell über den netzförmigen Katalysator geleitet, sonst würde das instabile NO in einem nächsten Schritt zu elementarem Stickstoff weiter zerfallen.
möglichst schnell über den netzförmigen Katalysator geleitet, sonst würde das instabile NO in einem nächsten Schritt zu elementarem Stickstoff weiter zerfallen.
Auch wird diesem Reaktor der Sauerstoff in einem überstöchiometrischem Verhältnis zugeführt, um die Entflammbarkeit des Ammoniaks und damit die Wärmeentwicklung durch die exotherme Reaktion unter Kontrolle zu halten. Des Weiteren hat man so auch schon den nötigen Sauerstoff für den nächsten Reaktionsschritt des Ostwaldverfahrens bereit gestellt.
Ostwald Verfahren: Weitere Oxidation von NO zu Stickstoffdioxid
In einem nächsten Schritt im Ostwaldverfahren wird das  -Gas durch Wärmetauscher gekühlt auf eine Temperatur von 50°C. Bei dieser Temperatur reagiert dann das Stickstoffmonoxid in einer weiteren Oxidation zu Stickstoffdioxid:
-Gas durch Wärmetauscher gekühlt auf eine Temperatur von 50°C. Bei dieser Temperatur reagiert dann das Stickstoffmonoxid in einer weiteren Oxidation zu Stickstoffdioxid:
+II +IV


Wegen dieser Reaktion erfolgt auch die vorherige Abkühlung, da  schon bei einer Temperatur von 150°C wieder komplett in
schon bei einer Temperatur von 150°C wieder komplett in  und
und  zerfällt. Das neu gewonnene Stickstoffdioxid steht in ständigem chemischem Gleichgewicht mit seinem Dimer, dem Distickstofftetraoxid
zerfällt. Das neu gewonnene Stickstoffdioxid steht in ständigem chemischem Gleichgewicht mit seinem Dimer, dem Distickstofftetraoxid  :
:


Ostwald Verfahren: Oxidation zu Salpetersäure
Beide Bestandteile, das  und das
und das  , fließen im nächsten Schritt des Ostwald Verfahren in eine Absorptionskolonne. Dort rieselt von oben fein verteilt Wasser hinunter und tritt in innigen Kontakt mit den beiden Gasen, die von unten einströmen.
, fließen im nächsten Schritt des Ostwald Verfahren in eine Absorptionskolonne. Dort rieselt von oben fein verteilt Wasser hinunter und tritt in innigen Kontakt mit den beiden Gasen, die von unten einströmen.
Das Wasser absorbiert bzw. löst beide Gase und reagiert dann mit dem Distickstofftetraoxid in einer Disproportionierungsreaktion folgendermaßen:
+IV +III +V

Dabei entsteht zum Teil schon die im Ostwaldverfahren gewünschte Salpetersäure ( ), aber auch salpetrige Säure (
), aber auch salpetrige Säure ( ). Diese zerfällt aber unter erhöhter Temperatur weiter zu:
). Diese zerfällt aber unter erhöhter Temperatur weiter zu:
+III +V +II

Auch das Stickstoffdioxid reagiert mit Wasser zu Salpetersäure:
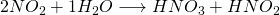
Salpetersäure und Salpetrige Säure sind dabei konstant im zugeführten Wasser gelöst und können so von dem wieder entstehenden NO-Gas, das beim Zerfall der Salpetrigen Säure entsteht, wieder getrennt werden. Das NO-Gas wird dann wieder dem vorherigen Reaktor des Ostwald Verfahrens als Edukt zugeführt, wo es wieder zu  oxidiert wird
oxidiert wird
Von oben fließt in die Rieselkolonne oftmals noch weiterer Sauerstoff, damit in geringerem Maße auch eine Gasphasenreaktion stattfinden kann, ohne dass sich vorher das Gasgemisch im Wasser lösen muss:

Durch diese weitere Reaktion kannst du den Umsatz an Salpetersäure im gesamten Ostwaldverfahren noch steigern.
In einem letzten Schritt wird im Ostwald Verfahren die erhaltene Salpetersäure Lösung (ca. 50%) noch durch eine Destillationskolonne geleitet, um die Konzentration auf 65% zu erhöhen.
Produkte des Ostwald Verfahrens
Mit dem Produkt Salpetersäure aus dem Ostwald Verfahren kann man dann weitere wichtige Grundstoffe herstellen. Eine häufige Anwendung ist die Umsetzung der Salpetersäure mit Ammoniak zu Ammoniumnitrat ( ):
):

Dieses ist ein häufig verwendeter chemischer Grundstoff. Zum einen findet er Anwendung als Grundstoff für die Düngemittelindustrie. Zum anderen kann es aufgrund seiner sehr hohen Reaktionsgeschwindigkeit, wenn es zusammen mit Luft gezündet wird, auch als Sprengstoff verwendet werden. Dabei entstehen auch nur gasförmige Produkte, was seine Sprengkraft weiterhin erklärt:

