Boudouard Gleichgewicht
Du hast vor kurzem etwas vom Boudouard Gleichgewicht gehört und möchtest jetzt noch mehr über dieses spannende Thema erfahren? Kein Problem, denn hier erklären wir dir wie du mit dem Prinzip von Le Chatelier,  in
in  effektiv umwandeln kannst.
effektiv umwandeln kannst.
Falls du das Ganze lieber in geballter Form in einem Video anschauen möchtest, dann klicke doch auf unser Video !
Inhaltsübersicht
Boudouard Gleichgewicht einfach erklärt
Das Boudouard Gleichgewicht beschreibt das chemische Gleichgewicht der Reaktion von Kohlenstoffmonoxid  zu Kohlenstoffdioxid
zu Kohlenstoffdioxid  .
.
Wenn man sich die Oxidationszahlen von Kohlenstoff ansieht, erkennt man, dass sie sich von anfangs +II, in zwei verschiedene Oxidationszahlen aufteilt, nämlich 0 und +IV.
+II +IV 0

Boudouard-Gleichgewicht und Prinzip von Le Chatelier
Das Boudouard-Gleichgewicht ist eine Reaktion, deren Gleichgewichtslage sich hervorragend über das Prinzip von Le Chatelier beschreiben lässt. Das heißt man kann mit diesem Prinzip einfach vorhersagen, ob das chemische Gleichgewicht unter gegebenem Druck und Temperatur auf der Edukt- oder auf der Produktseite liegt.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Boudouard Gleichgewicht Druckabhängigkeit
Zuerst zur Druckabhängigkeit der Reaktion. Schauen wir uns dazu nochmal die Reaktionsgleichung an:

Das Prinzip von Le Chatelier sagt für Reaktionen in der Gasphase aus, dass bei einer Druckerhöhung sich das Gleichgewicht auf die Seite der Reaktion schiebt, auf der weniger Teilchen in der Gasphase sind. Schaut man sich obige Gleichung an, sieht man, dass auf der Eduktseite zwei  Teilchen in der Gasphase sind und auf der Produktseite nur ein Teilchen in der Gasphase ist. Kohlenstoff liegt in fester Form vor und zählt daher nicht mit. Daher verschiebt sich das Gleichgewicht auf die Seite vom Kohlenstoffdioxid, wenn man den Druck erhöht.
Teilchen in der Gasphase sind und auf der Produktseite nur ein Teilchen in der Gasphase ist. Kohlenstoff liegt in fester Form vor und zählt daher nicht mit. Daher verschiebt sich das Gleichgewicht auf die Seite vom Kohlenstoffdioxid, wenn man den Druck erhöht.
Man sollte dabei beachten, dass sich hierbei nicht die Gleichgewichtskonstante an sich ändert, sondern nur die Partialdrücke der Reaktanden im Ausdruck für die Gleichgewichtskonstante:
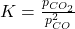
 =Gleichgewichtskonstante;
=Gleichgewichtskonstante;  =Partialdruck
=Partialdruck  ;
;  =Partialdruck
=Partialdruck 
Boudouard Gleichgewicht Temperaturabhängigkeit
Desweiteren kann man das Boudouard Gleichgewicht auch über die Temperatur beeinflussen. Schauen wir uns dazu wieder an, was das Prinzip von Le Chatelier dazu sagt. Nach dem Prinzip von Le Chatelier wird bei exothermen Reaktionen bei einer Temperaturerhöhung das Gleichgewicht auf die Seite der Edukte verschoben.


Man sieht am negativen Vorzeichen der Reaktionsenthalpie, dass die Reaktion von  zu
zu  exotherm ist. Daher verschiebt sich das Gleichgewicht bei einer Temperaturerhöhung also auf die Seite von
exotherm ist. Daher verschiebt sich das Gleichgewicht bei einer Temperaturerhöhung also auf die Seite von  . Wenn man die Partialdrücke von
. Wenn man die Partialdrücke von  und
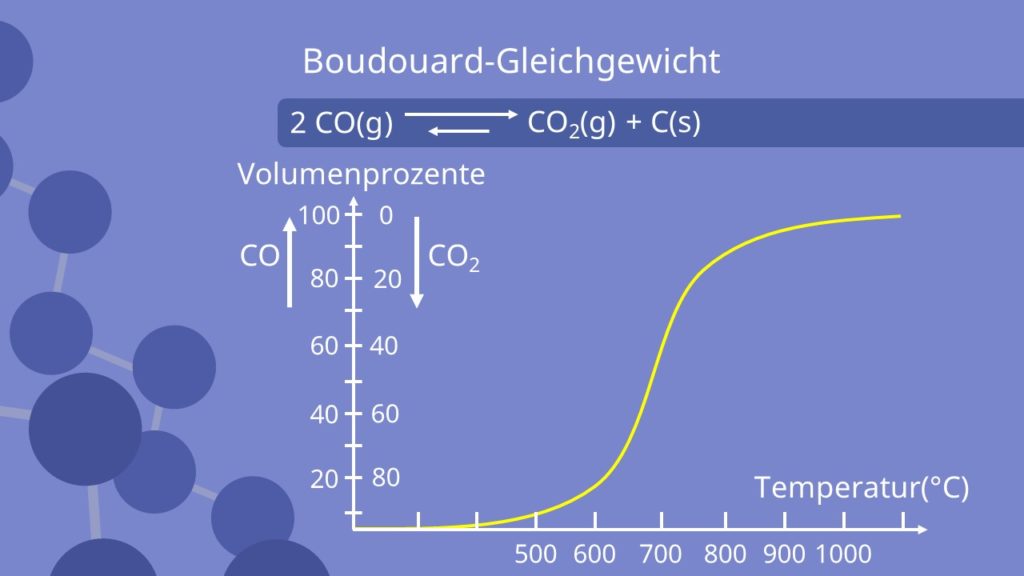
und  über einen breiteren Temperaturbereich aufträgt, ergibt sich folgende Kurve.
über einen breiteren Temperaturbereich aufträgt, ergibt sich folgende Kurve.
Man erkennt, dass bei steigenden Temperaturen der Partialdruck von  deutlich ansteigt, sich also das Gleichgewicht deutlich auf die Seite von
deutlich ansteigt, sich also das Gleichgewicht deutlich auf die Seite von  verschiebt.
verschiebt.
Boudouard Gleichgewicht im Hochofenprozess
Wie schon gesagt, ist die Boudouard Gleichgewicht im Hochofenprozess von zentraler Bedeutung. Dort reduziert das Kohlenstoffmonoxid den Rohstoff Eisenerz in mehreren Reaktionsschritten zu elementarem Eisen. Eine Reaktion, die dabei abläuft, ist folgende:
+II +II +IV 0

Man erkennt an den Oxidationszahlen: Eisenoxid wird reduziert und Kohlenstoffmonoxid wird oxidiert zu  . Da im Hochofen konstant hohe Temperaturen von über 1000°C herrschen, wird ständig das bei der Reduktion von Eisenoxid entstehende
. Da im Hochofen konstant hohe Temperaturen von über 1000°C herrschen, wird ständig das bei der Reduktion von Eisenoxid entstehende  wieder zurückverwandelt werden über das Boudouard Gleichgewicht:
wieder zurückverwandelt werden über das Boudouard Gleichgewicht:

Somit kann der Prozess immer weiter stattfinden bis gar keine Kohle mehr da ist. Das beim Hochofenprozess entstandene Roheisen kann man dann später in den wichtigen Baustoff Stahl umwandeln. Falls du jetzt noch einmal Lust bekommen hast mehr über den Hochofenprozess zu erfahren, dann klicke doch hier .
Boudouard Gleichgewicht Generatorgas
Im 19. und 20. Jh. haben die Leute hauptsächlich noch mit Kohle geheizt. Beim Heizen mit Kohle handelt es sich um eine Reaktion von Kohlenstoff mit Sauerstoff:

Dabei handelt es sich um eine stark exotherme Reaktion, die also viel Wärme erzeugt. Allerdings kann man diese nicht nur zum Heizen verwenden, sondern sie wird auch für das Boudouard Gleichgewicht wieder aufgewandt:

Die Reaktion von  zu
zu  ist endotherm und somit wird durch die frei werdende Hitze auch wieder Kohlenmonoxid erzeugt.
ist endotherm und somit wird durch die frei werdende Hitze auch wieder Kohlenmonoxid erzeugt.
Früher hat man das bei der Kohleverbrennung entstandene Generatorgas hauptsächlich zum Erhitzen des Stahls in der Härte- und Glühindustrie verwendet.
Allerdings muss man auch beim heimischen Betrieb von Kohleöfen in geschlossenen Räumen aufpassen. Denn beim Verbrennen von Holz laufen genau die obigen Reaktionen ab. Es entsteht also auch Kohlenmonoxid. Auch die niedrigen Temperaturen im Zimmer, bei denen eigentlich kein  vorliegen sollte, schützen nicht. Denn die Umwandlung vom giftigen
vorliegen sollte, schützen nicht. Denn die Umwandlung vom giftigen  in das ungefährliche
in das ungefährliche  benötigt eine gewisse Aktivierungsenergie, die bei Raumtemperatur aber nicht vorhanden ist. Es ist also metastabil. Also liegt auch bei Raumtemperatur eine gewisse Konzentration von
benötigt eine gewisse Aktivierungsenergie, die bei Raumtemperatur aber nicht vorhanden ist. Es ist also metastabil. Also liegt auch bei Raumtemperatur eine gewisse Konzentration von  vor, die auch schädlich ist.
vor, die auch schädlich ist.