Haber Bosch Verfahren
Was das Haber Bosch Verfahren ist, wie es aufgebaut ist und wozu es genutzt wird, erfährst du alles in unserem Video und im Beitrag!
Inhaltsübersicht
Haber Bosch Verfahren einfach erklärt
Das Haber-Bosch-Verfahren dient der synthetischen Herstellung von Ammoniak NH3 mithilfe von Wasserstoff H2 und Stickstoff N2. Die Chemiker Fritz Haber (1868–1934) und Carl Bosch (1874–1940) haben das Verfahren entwickelt, um Ammoniak für den landwirtschaftlichen Gebrauch erstmalig im industriellem Maßstab herzustellen.
Um Ammoniak herzustellen, reagieren Wasserstoff und Stickstoff beim Haber-Bosch-Verfahren miteinander.
![Rendered by QuickLaTeX.com \[3H_2 + N_2 \leftrightarrow 2NH_3\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-0487d2913270be790fadc4a73d3eecfb_l3.png)
Stickstoff ist aber sehr reaktionsträge und kann nur durch enormen Energieaufwand zu einer Reaktion gebracht werden. Damit diese Reaktion effizient abläuft, sind Temperaturen von ca. 450°C und ein Druck von mindestens 200-300 bar notwendig. Außerdem wird N2 im Überschuss hinzugegeben.
Die hohen Reaktionsbedingungen benötigen sehr viel Energie. Der Prozess benötigt sogar so viel Energie, dass er 1,1% des gesamten weltweiten Energieverbrauchs ausmacht.
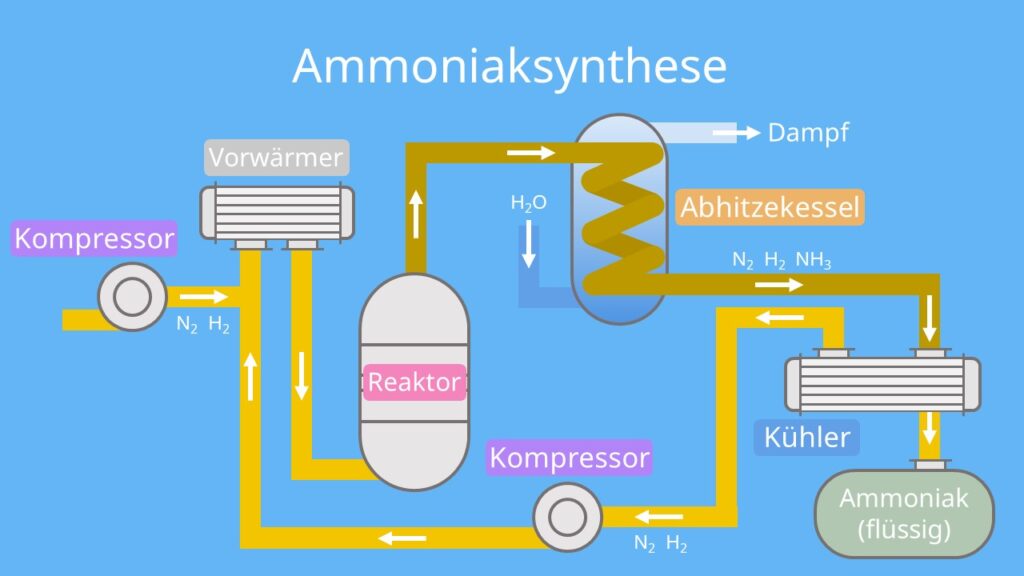
Haber Bosch Verfahren Aufbau – Ammoniaksynthese
Um die spezifischen Bedingungen von Temperatur, Druck und Konzentration für die Ammoniaksynthese zu gewährleisten, nutzt du beim Haber Bosch Verfahren einen bestimmten Aufbau.
Als Ausgangsstoffe für die Ammoniaksynthese nutzt du ein Synthesegas, also ein Gasgemisch aus H2 und N2. Das Gas wird über einen Vorwärmer in den Reaktor des Haber Bosch Verfahrens transportiert.
- Kompressor: Ein Kompressor setzt das Gasgemisch aus H2 und N2 einem Druck von 300 bar aus.
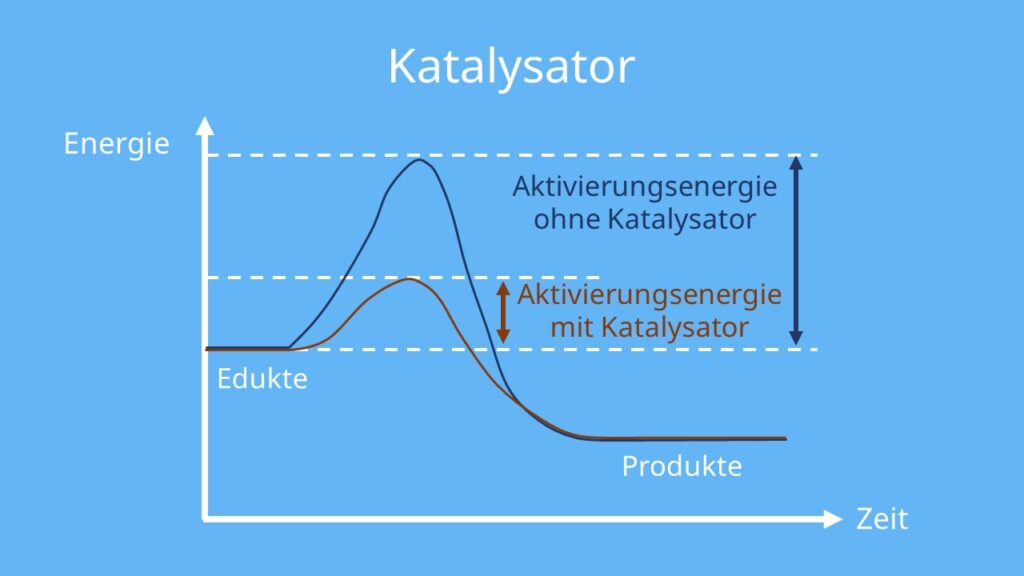
- Reaktor: Der Reaktor erhitzt das Synthesegas unter einem Druck von 300 bar auf 450°C. Damit die Reaktion starten kann, ist ein Katalysator aus Magnetit notwendig. Er senkt die Aktivierungsenergie der Reaktion. Ungefähr 20% des zugeführten H2 und N2 reagieren zu NH3. Das gewonnene Ammoniakgas und das nicht reagierte Stickstoff- und Wasserstoffgas strömen danach in einen Abhitzekessel.
- Abhitzekessel: Im Abhitzekessel werden die heißen Gase das erste Mal abgekühlt. In mehreren Stufen kühlen die Gase mithilfe von Wasser ab. Zur weiteren Abkühlung fließen die Gase zu einem besonderen Kühler.
- Kühler: Hier kühlt Ammoniak so weit, dass es kondensiert und flüssig wird. So trennt es sich vom Gasgemisch und wird in einem Tank gespeichert. Das nicht reagierte H2 und N2 fließt durch einen Kompressor und anschließend in den Reaktor.
- Kompressor: Im letzten Schritt setzt ein weiterer Kompressor die H2– und N2-Resten auf einen Druck von 300 bar und speist sie wieder in den Kreislauf des Haber Bosch Verfahrens ein.
Haber Bosch Verfahren Synthesebedingungen
Die Ammoniaksynthese ist eine Gleichgewichtsreaktion , bei der du 3 Wasserstoffmoleküle zusammen mit 1 Stickstoffmolekül zu 2 Ammoniakmolekülen reagieren lässt:
![Rendered by QuickLaTeX.com \[3H_2 + N_2 \leftrightarrow 2NH_3\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-0487d2913270be790fadc4a73d3eecfb_l3.png)
Das heißt, es reagieren nur so viele H2-Moleküle und N2-Moleküle (Edukte) zu NH3 (Produkt), bis die Edukte und Produkte ein bestimmtes Gleichgewicht erreichen.
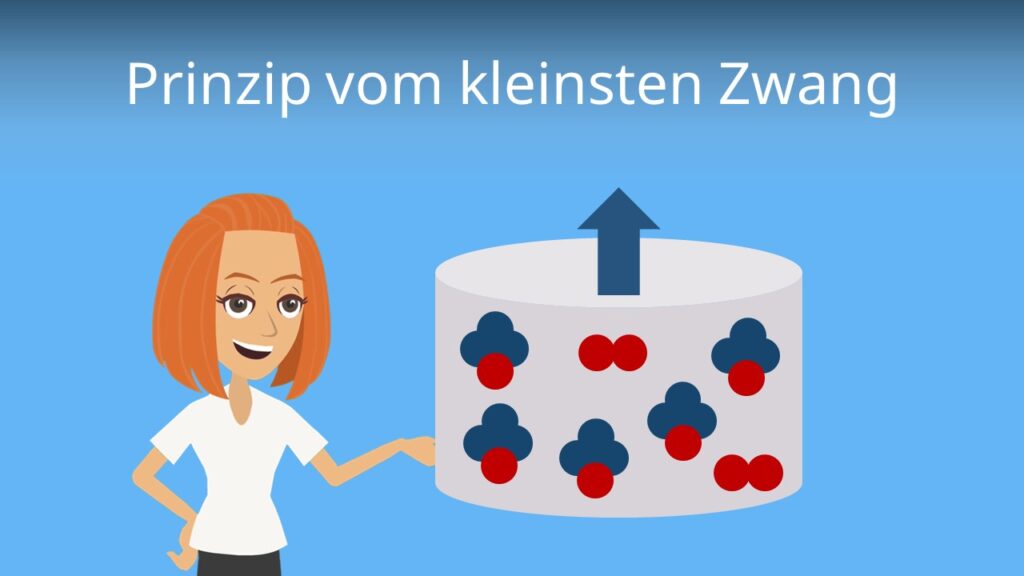
Das Gleichgewicht kannst du durch das Prinzip von Le Chatelier (Prinzip des kleinsten Zwangs) mithilfe der Faktoren Temperatur, Druck und Konzentration beeinflussen, um die Ausbeute von Ammoniak zu optimieren.
Haber Bosch Verfahren Temperatur
Damit N2 überhaupt mit H2 reagieren kann, musst du die Dreifachbindung von N2 auflösen. Dafür benötigst du eine Aktivierungsenergie von ca. 500°C, wenn du zusätzlich einen Katalysator verwendest (ohne Katalysator ca. 1000°C). Außerdem beschleunigst du mit einer hohen Temperatur und Katalysator die Reaktionsgeschwindigkeit, sodass du Ammoniak schneller bildest.
Jedoch stößt du auf ein Problem. Die Ammoniaksynthese aus H2 und N2 ist eine exotherme Reaktion. Das bedeutet, hohe Temperaturen verschieben das Reaktionsgleichgewicht auf die Eduktseite (also H2 und N2), sodass weniger Ammoniak gebildet wird. Deshalb nutzt du beim Haber Bosch Verfahren einen Mittelweg aus Reaktionsgeschwindigkeit und Reaktionsgleichgewicht bei einer Temperatur von 450°C.
Haber Bosch Verfahren Druck
H2, N2 und NH3 treten in Form von Gasen auf. Durch hohen Druck kannst du Gase wie H2 und N2 zusammendrücken, sodass sie weniger Platz haben.
Dadurch verschiebst du das Gleichgewicht auf Produktseite, weil NH3 als Gas weniger Platz braucht als die Ausgangstoffe. Um also mehr Ammoniak herzustellen, läuft die Reaktion bei einem Druck von 300 bar ab.
Haber Bosch Verfahren Konzentration
Bei einer Gleichgewichtsreaktion erhältst du mehr Edukte oder Produkte abhängig davon, welche Seite der Gleichgewichtsreaktion weniger vorhanden ist.
Um mehr NH3 zu bilden, stellst du N2 beim Haber Bosch Verfahren also im Überschuss bereit (H2 nicht, weil es relativ schwer herzustellen ist). Außerdem wird bereits gebildetes NH3 regelmäßig entfernt, damit das Gleichgewicht der Reaktion zu Gunsten der Produktbildung liegt.
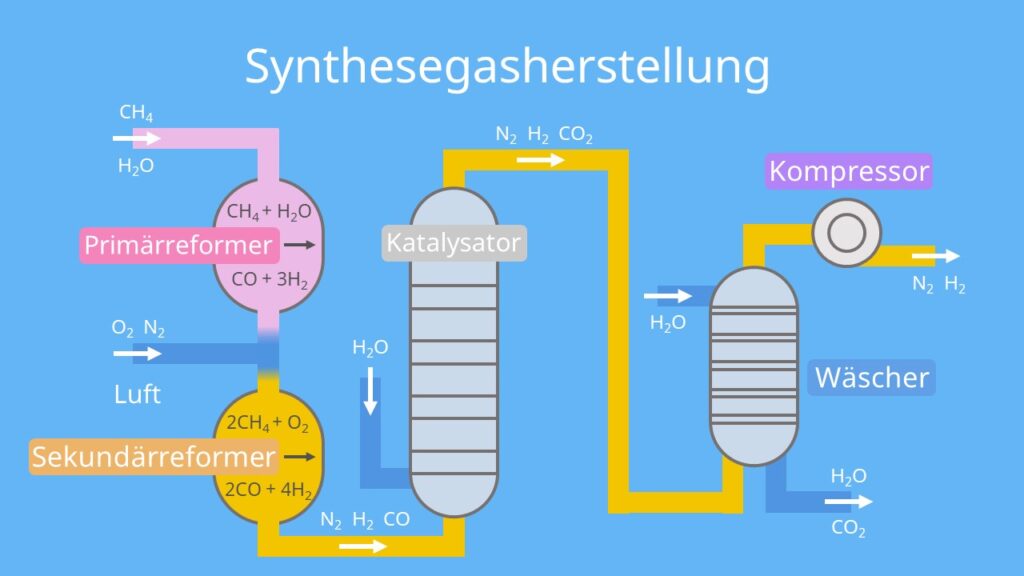
Haber Bosch Verfahren Aufbau – Synthesegasherstellung
Damit die Ammoniaksynthese überhaupt stattfinden kann, wird im Vorwege ein Synthesegas aus H2 und N2 erzeugt. Dafür setzt du Methan , Wasser und Luft durch die folgende Konstruktion um:
- Primärreformer: Der Primärreformer ist ein Behälter mit einem Nickeloxid-Aluminiumoxid-Katalysator. Hier wandelt sich Methan CH4 und Wasserdampf H20 zu Kohlenstoffmonoxid CO und Wasserstoff H2 um. Jedoch wandelt sich Methan nicht vollständig um, weshalb es zusammen mit CO und H2 zum Sekundärreformer geschickt wird.
- Sekundärreformer: Hier dringen Sauerstoff O2 und Stickstoff N2 in Form von Luft ein. Aus Sauerstoff und Methan bildet sich noch mehr Kohlenstoffmonoxid und Wasserstoff. Als Nächstes werden H2 ,N2 und CO zu einem Katalysator weitergeleitet.
- Katalysator: In einem Behälter mit Katalysator und 500°C entsteht CO2. Das passiert durch die sogenannte Wassergas-Shift-Reaktion. Nun werden H2, N2 und CO2 zu einem Wäscher transportiert.
- Wäscher: Der Wäscher befreit das Gasgemisch von CO2. So entsteht ein Synthesegas aus H2 und N2, welches zu einem Kompressor fließt und der Ammoniaksynthese bereitsteht.
Synthesegas-Herstellung
Um das Synthesegas zu erhalten, musst du zuerst die einzelnen Komponenten Wasserstoff H2 und Stickstoff N2 herstellen. Für die Gewinnung von H2 lässt du Wasserdampf H20 und Methan CH4 reagieren. Dafür nutzt du einen Nickeloxid–Alumiumoxid-Katalysator, um die Ausbeute von H2 zu erhöhen.
![Rendered by QuickLaTeX.com \[CH_4(g) + H_2O(g) \leftrightarrow 3H_2(g) + CO(g)\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-efb9ae26a7df301375344ba585c30fcf_l3.png)
Dadurch erhältst du H2 und Kohlenstoffmonoxid CO. Da es sich hierbei um eine Gleichgewichtsreaktion handelt, setzt du Methan nicht komplett um. Stattdessen führst du Luft hinzu, welches sowohl Stickstoff als auch Sauerstoff enthält. So kann dein Methan nun mit Sauerstoff zu CO und H2 reagieren.
![Rendered by QuickLaTeX.com \[2CH_4(g ) + O_2(g) \rightarrow 4H_2(g) + 2CO(g)\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-d41322b62e3ca04e40d2924809138a87_l3.png)
Jetzt stehen dir H2, N2 und CO bereit für die nächste Reaktion.
Wassergas-Shift Reaktion
Bei der Wassergas-Shift Reaktion wandelst du Kohlenstoffmonoxid CO mithilfe von Wasser zu Kohlenstoffdioxid CO2 um. Das tust du aus drei Gründen:
- CO ist stark gesundheitsschädlich.
- CO und Ammoniak reagieren zusammen zu einem Feststoff, welcher deine Leitungen verstopfen würde.
- CO kannst du schwerer aus dem Synthesegas waschen als CO2.
Daher oxidierst du CO mithilfe von H2O zu CO2.
![Rendered by QuickLaTeX.com \[H_2O(g) + CO (g) \leftrightarrow H_2(g) + CO_2(g)\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-7bd9605cdfc0f24a0b64b8e11e8b8119_l3.png)
Dadurch erhältst du Kohlenstoffdioxid und sogar noch mehr Wasserstoff. Anschließend kannst du das CO2 durch Triethanolamin rauswaschen, sodass du ein Synthesegas aus H2 und N2 übrig hast.
Ammoniaksynthese
Bei der Ammoniaksynthese reagiert Methan durch einen Katalysator mit Wasserdampf und Luft. Dabei entsteht ein Synthesegas aus Wasserstoff und Stickstoff. So können Wasserstoff (H2) und Stickstoff (N2) zu Ammoniak (NH3) reagieren.
Dabei läuft deine Reaktion in einem Verhältnis von 3 (H2) zu 1 (N2) nach folgendem Schema ab:
![Rendered by QuickLaTeX.com \[3H_2 + N_2 \leftrightarrow 2NH_3\]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-1110432e3f6889313e6ab87bef2a51f2_l3.png)
Stickstoff ist aber sehr unreaktiv. Daher benötigst du einen Katalysator, um die Aktivierungsenergie der Reaktion herabzusetzen.
So erhöhst du die Reaktionsgeschwindigkeit und damit die Ausbeute pro Zeit. Dafür nutzt du meistens eisenhaltige Katalysatoren wie zum Beispiel Magnetit Fe3O4. Das kannst du mit weiteren Verbindungen wie Aluminiumoxid Al2O3 versetzen, um die Wirksamkeit noch weiter zu erhöhen.
Prinzip vom kleinsten Zwang
Beim Haber Bosch Verfahren wird das Prinzip vom kleinsten Zwang genutzt, um die Ammoniakausbeute zu maximieren! Doch was genau besagt das Prinzip, welches du auch Prinzip von Le Chatelier nennst, überhaupt? Das findest du in unserem Video heraus!