Adsorption
In diesem Artikel erklären wir dir, was eine Adsorption ist und wie sie sich von der Absorption unterscheidet. Außerdem definieren wir die wichtigsten Grundbegriffe der Adsorption und beispielhafte Anwendungsszenarien dazu.
Du willst den Inhalt dieses Artikels in kürzester Zeit verstehen? Dann schau dir gerne unser Video zur Adsorption an.
Inhaltsübersicht
Adsorption einfach erklärt
Feststoffe adsorbieren umso besser, je größer deren Oberfläche und je poröser sie sind. Die Adsorption lässt sich, genau wie die Absorption, zur Sorption zuordnen. Diese bezeichnet einen Sammelbegriff, der für die Anreicherung eines Stoffes innerhalb einer Phase oder auf einer Grenzfläche zwischen zwei Phasen steht. Die Adsorption lässt sich in eine physikalische (Physisorption) und eine chemische (Chemisorption) unterteilen.
Anwendung findet die Adsorption bei Adsorptionsmitteln wie Aktivkohle oder Kieselgel zur Reinigung von verschiedenen Gasen oder Flüssigkeiten.
Adsorption Absorption
Du solltest die Begriffe der Adsorption und Absorption nicht verwechseln. Während bei der Adsorption Stoffe nur oberflächlich anlagern, bezeichnet die Absorption ein Eindringen der Stoffe ins Innere eines Materials. So können diese Stoffe stärkere Bindungen ausprägen und es kann zu einer Lösung von Stoffen im Inneren des Materials kommen. Die Absorption lässt sich in eine chemische Absorption und eine physikalische Absorption unterteilen. Diese unterscheiden sich dadurch, dass die chemische Struktur entweder bestehen bleibt (physikalische Adsorption) oder sich verändert (chemische Adsorption).
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Desorption
Die Desorption stellt den Umkehrvorgang der allgemeinen Sorption dar. Hierbei verlassen Atome oder Moleküle entweder die Oberfläche eines Körpers oder sie werden aus einer Flüssigkeit herausgezogen. Wenn du eine Desorption ausführen möchtest, musst du ein gewisses Maß an Energie zuführen. Die Desorption lässt sich je nach Herkunft der erforderlichen Energie in unterschiedliche Bereiche einteilen. So existieren beispielsweise eine thermische Desorption, eine akustische Desorption, eine elektrische Desorption und eine optische Desorption. Die ionenstimulierende Desorption ist es möglich, die Oberfläche der adsorbierenden Stoffe zu reinigen.
Adsorbens
Ein Adsorbens oder auch Adsorptionsmittel genannt, ist ein Festkörper, der in der Lage ist, Teilchen an der Oberfläche/Grenzfläche eines Stoffes festzuhalten, also zu adsorbieren. Diese Teilchen müssen entweder in der gasförmigen oder in der flüssigen Phase vorliegen.
Adsorbat
Ein Adsorbat ist ein Teilchen, das direkt an der festen Oberfläche (Adsorbens) angelagert wird. Dieses wird also vom Adsorbens direkt adsorbiert. Oft wird auch die Kombination von Adsorbens und dem adsorbierten Stoff direkt an der Oberfläche (=Adsorpt) Adsorbat genannt.
Adsorptiv
Als Adsorptive werden Teilchen bezeichnet, die sich nicht direkt an dem Adsorbens anlagern, sondern frei in der gasförmigen oder flüssigen Phase vorliegen.
Physisorption
Du kannst zwischen einer physikalischen und einer chemischen Adsorption unterscheiden. Bei der physikalschen Adsorption, oder auch Physisorption, verändern sich die Adsorptionsmoleküle nur geringfügig . Zwischen Adsorbat und Adsorbens herrschen längere, schwächere Bindungskräfte wie zum Beispiel Dipol-Dipol Wechselwirkungen, Van-der-Waals-Kräfte
oder Wasserstoffbrückenbindungen
. Wegen der größeren Entfernung der Bindungskräfte können sich mehrere Adsorptionsschichten übereinander bilden. Außerdem benötigt eine Physisorption keine hohe Aktivierungsenergie (ca.  ) und läuft dadurch schneller ab als die chemische Adsorption. Weiterhin ist die physikalische Adsorption vollständig reversibel.
) und läuft dadurch schneller ab als die chemische Adsorption. Weiterhin ist die physikalische Adsorption vollständig reversibel.
Chemisorption
Die chemische Adsorption oder Chemisorption beruht auf stärkeren und kürzeren, chemischen Bindungskräften. Deshalb bildet sich bei Anwendung einer erhöhten Aktivierungsenergie nur eine monomolekulare Schicht aus. Die benötigte Energie beträgt hierbei meist um die  .
.
Die Adsorptionsmoleküle werden beim Auftreffen auf den Adsorbens in ihrer Bindungsstruktur und Elektronenverteilung chemisch verändert. Daher ist dieser Vorgang entweder nur mit hohen Temperaturen oder einer chemischen Behandlung der Oberfläche rückgängig zu machen. Grundsätzlich ist die Chemisorption aber irreversibel, also lässt sich das Chemisorptionsmittel sich meist nicht durch Desorption zurückgewinnen. Die chemische Adsorption ist außerdem chemische selektiv, d.h. sie findet nur bei bestimmten Adsorpt-Adsorbens Paaren statt.
Adsorptionsisotherme
Grundsätzlich beschreibt eine Sorptionsisotherme den Gleichgewichtszustand der Sorption eines Stoffes bei konstanter Temperatur.
Die Adsorptionsisotherme stellt eine Zusammenhang zwischen der Bedeckung der Oberfläche und der Adsorptiv-Konzentration dar. Dabei sind die Atome in der gas- oder flüssigen Phase immer in einem Gleichgewicht mit den Atomen, die an der Grenzfläche des Adsorbens adsorbiert sind.
Die Adsorptiv-Konzentration wird in der flüssigen Phase mit  und in der gasförmigen Phase als Partialdruck in
und in der gasförmigen Phase als Partialdruck in  ausgedrückt.
ausgedrückt.
Die am häufigsten verwendeten Isothermen sind die Henry Isotherme, die Freundlich Isotherme und die Langmuir Isotherme.
Henry Isothermen finden meistens im Bereich von niedrigen Konzentrationen Verwendung, da sie keine Wechselwirkungen unter den Teilchen berücksichtigen.
Sie sehen wie folgt aus:

 bezeichnet die Beladung des Sorbents,
bezeichnet die Beladung des Sorbents,  steht für die Adsorptiv-Konzentration und
steht für die Adsorptiv-Konzentration und  ist ein linerarer Koeffizient namens Henry Konstante. Die Henry Konstante ist ein Maß für die Aufnahmefähigkeit eines Gases in einer Wasserphase-Lösung. Diese unterscheidet sich je nach betrachtetem Gas.
ist ein linerarer Koeffizient namens Henry Konstante. Die Henry Konstante ist ein Maß für die Aufnahmefähigkeit eines Gases in einer Wasserphase-Lösung. Diese unterscheidet sich je nach betrachtetem Gas.
Eine weitere wichtige Isotherme ist die sogenannte Freundlich Isotherme. Bei dieser werden, im Gegensatz zur Henry Isothermen, Wechselwirkungen zwischen den Teilchen berücksichtigt:

 ist der sogenannte Freundlich Koeffizient und
ist der sogenannte Freundlich Koeffizient und  verbindet die Adsorptiv-Konzentration mit dem Freundlich Exponent
verbindet die Adsorptiv-Konzentration mit dem Freundlich Exponent  .
.
Bei der Langmuir Isotherme wird berücksichtigt, dass eine maximale Anzahl an vorhandenen Adsorptionsplätzen existiert. Wechselwirkungen werden hier wieder vernachlässigt:

Der Ausdruck  bezeichnet den Wert für
bezeichnet den Wert für  , wenn das Adsorptionsmittel mit einer geschlossenen Monoschicht des Adsorbates bedeckt ist. Der Langmuir-Sorptionskoeffizient wird mit
, wenn das Adsorptionsmittel mit einer geschlossenen Monoschicht des Adsorbates bedeckt ist. Der Langmuir-Sorptionskoeffizient wird mit  bezeichnet.
bezeichnet.
Bedeckungsgrad
Der Adsorbens besitzt immer eine begrenzte Zahl an Adsorptionsplätzen. Das Verhältnis der besetzten und unbesetzen Adsorptionplätze kannst du durch den Bedeckungsgrad  angeben:
angeben:

 steht hierbei für die Anzahl der besetzten Adsorptionsplätze und
steht hierbei für die Anzahl der besetzten Adsorptionsplätze und  für die vorhandenen Adsorptionsplätze. Bei einem Wert von
für die vorhandenen Adsorptionsplätze. Bei einem Wert von  sind alle Plätze frei und bei einem Wert von
sind alle Plätze frei und bei einem Wert von  sind alle Plätze besetzt. Der Bedeckungsgrad ist dimensionslos.
sind alle Plätze besetzt. Der Bedeckungsgrad ist dimensionslos.
Die Beladung  setzt sich aus dem Bedeckungsgrad
setzt sich aus dem Bedeckungsgrad  , der Konzentration der geschlossenen Monoschicht
, der Konzentration der geschlossenen Monoschicht  und der spezifischen Oberfläche des Adsorptionsmittels
und der spezifischen Oberfläche des Adsorptionsmittels  zusammen:
zusammen:
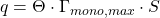
Anwendung
Aufgrund einiger Eigenschaften wird die Adsorption für die industrielle Verwendung eingesetzt. Zum einen können die adsorbierenden Stoffe (=Adsorbentien) im Voraus durch einige Methoden behandelt werden. Dadurch lassen sich günstige Bedingungen schaffen, um eine schnellere und zuverlässige Reaktion zu gewährleisten. Außerdem lässt sich eine Adsorption auch für geringe Adsorptiv-Konzentrationen realisieren. Weiterhin ist es mit einer Adsorption möglich, eine einzelne Komponente relativ einfach aus einem Gemisch zu trennen. Diesen Umstand nutzen verschiedene Chromatographieverfahren, wie zum Beispiel die Dünnschichtchomatographie , aus.
Du kannst das Prinzip der Adsorption für die unterschiedlichsten Anwendungen verwenden. Wegen ihrer unterschiedlichen Eigenschaften, besitzen Physisorption und Chemisorption verschiedenen Anwendungsgebiete.
Durch ihre schnelle Umsetzung wird die Physisorption zur zeiteffizienten Adsorption von Gasen an frischen Oberflächen in verschiedenen Pumpen genutzt. Zu weiteren Anwendungsfeldern zählt die Aufbereitung von Trinkwasser und die Reinigung von Abwässern oder Luft. Dabei werden unterschiedlichste Filter aus Aktivkohle oder Kieselgel verwendet.
Die Chemisorption wird hauptsächlich bei heterogen katalytischen Verfahren, wie dem Haber Bosch Verfahren angewendet. Außerdem wirken einige Trocknungsmittel wie zum Beispiel Molekularsiebe oder Bentonit durch das Prinzip der Chemisorption.

