Elektrochemische Spannungsreihe
Was sagt die elektrochemische Spannungsreihe aus und wie kannst du aus ihr das Verhalten eines Redoxpaares in einer Reaktion bestimmen? Genau das zeigen wir dir in diesem Beitrag und im Video.
Inhaltsübersicht
Elektrochemische Spannungsreihe einfach erklärt
Du kannst dir unter der elektrochemischen Spannungsreihe, oft auch nur Spannungsreihe genannt, eine Auflistung von Elementen mit deren Standardpotentialen vorstellen. Das Standardpotential gibt dir Informationen darüber, wie hoch die Kraft einer Elektrode ist, Elektronen anzuziehen.
Somit kannst du aus der Spannungsreihe das Redoxverhalten eines Stoffes ableiten und vorhersagen, ob und in welche Richtung die Redoxreaktion bei Standardbedingungen abläuft. Bei Metallen wird sie oft auch als Redoxreihe bezeichnet. Genutzt wird die elektrochemische Spannungsreihe oft zur Untersuchung von galvanischen Zellen.
Elektrochemische Spannungsreihe Tabelle
In der nachfolgenden Tabelle sind die einzelnen korrespondierenden Redoxpaare nach ihrem Standardpotential unter folgenden Bedingungen gelistet: T =  , p =
, p =  , pH = 0 und einer Aktivität der Ionen von
, pH = 0 und einer Aktivität der Ionen von  . Ein Redoxpaar bezeichnet dabei die reduzierte und oxidierte Form eines Elements, eines Ions oder einer Verbindung (Bsp.:
. Ein Redoxpaar bezeichnet dabei die reduzierte und oxidierte Form eines Elements, eines Ions oder einer Verbindung (Bsp.:  oder
oder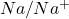 ).
).
| Element | oxidierte Form + z e– ⇌ reduzierte Form | Standardpotential E0 |
| Fluor (F) | F2 + 2 e– ⇌ 2 F– | +2,87 V |
| Schwefel (S) | S2O82- + 2 e– ⇌ 2SO42- | +2,00 V |
| Sauerstoff (O) | H2O2 + 2H3O+ + 2e– ⇌ 4H2O | +1,78 V |
| Gold (Au) | Au+ + e– ⇌ Au | +1,69 V |
| Gold (Au) | Au3+ + 3e– ⇌ Au | +1,42 V |
| Gold (Au) | Au3+ + 2e– ⇌ Au+ | +1,40 V |
| Chlor (Cl) | Cl2 + 2e– ⇌ 2Cl– | +1,396 V |
| Chrom (Cr) | Cr6++ 3e– ⇌ Cr3+ | +1,36 V |
| Sauerstoff (O) | O2 + 4H+ + 4e– ⇌ 2H 2O | +1,23 V |
| Platin (Pt) | Pt2++ 2e– ⇌ Pt | +1,20 V |
| Iridium (Ir) | Ir3+ + 3e– ⇌ Ir | +1,16V |
| Brom (Br) | Br2 + 2e– ⇌ 2Br– | +1,07 V |
| Nickel (Ni) | NiO2 + 2H2O + 2e– ⇌ Ni(OH) 2 + 2OH– | +0,98 V |
| Silicium (Si) | SiO2 + 4H+ + 4e– ⇌ Si + 2H2O | +0,86 V |
| Palladium (Pd) | Pd2+ + 2e– ⇌ Pd | +0,92 V |
| Quecksilber (Hg) | Hg2+ + 2e– ⇌ Hg | +0,85 V |
| Silber (Ag) | Ag+ + e– ⇌ Ag | +0,80 V |
| Eisen (Fe) | Fe3++ e– ⇌ Fe2+ | +0,77 V |
| Tellur (Te) | Te4+ + 4e– ⇌ Te | +0,57 V |
| Iod (I) | I2 + 2e– ⇌ 2I– | +0,53 V |
| Kupfer (Cu) | Cu+ + e– ⇌ Cu | +0,52 V |
| Sauerstoff (O) | O2 + 2H2O + 4e– ⇌ 4OH – | +0,40 V |
| Eisen (Fe) | [Fe(CN)6]3- + e– ⇌ [Fe(CN)6]4- | +0,361 V |
| Kupfer (Cu) | Cu2+ + 2e– ⇌ Cu | +0,34 V |
| Bismut (Bi) | Bi3+ + 3e– ⇌ Bi | +0,34 V |
| Kupfer (Cu) | Cu2+ + e– ⇌ Cu+ | +0,16 V |
| Zinn (Sn) | Sn4++ 2e– ⇌ Sn2+ | +0,15 V |
| Wasserstoff (H) | 2H++ 2e– ⇌ H2 | 0 |
| Eisen (Fe) | Fe3+ + 3e– ⇌ Fe | -0,04 V |
| Wolfram (W) | WO2 + 4H+ + 4e– ⇌ W + 2H2O | -0,12 V |
| Blei (Pb) | Pb2+ + 2e– ⇌ Pb | -0,13 V |
| Zinn (Sn) | Sn2+ + 2e– ⇌ Sn | -0,14 V |
| Molybdän (Mo) | Mo3+ + 3e– ⇌ Mo | -0,20 V |
| Nickel (Ni) | Ni2+ + 2e– ⇌ Ni | -0,23 V |
| Cobalt (Co) | Co2+ + 2e– ⇌ Co | -0,28 V |
| Thallium (Tl) | Tl+ + e– ⇌ Tl | -0,34 V |
| Indium (In) | In3+ + 3e– ⇌ In | -0,34 V |
| Cadmium (Cd) | Cd2+ + 2e– ⇌ Cd | -0,40 V |
| Eisen (Fe) | Fe2+ + 2e– ⇌ Fe | -0,41 V |
| Schwefel (S) | S + 2e– ⇌ S2- | -0,48 V |
| Gallium (Ga) | Ga3+ + 3e– ⇌ Ga | -0,55 V |
| Chrom (Cr) | Cr3+ + 3e– ⇌ Cr | -0,76 V |
| Zink (Zn) | Zn2+ + 2e– ⇌ Zn | -0,76 V |
| Wasser | 2H2O + 2e– ⇌ H2 + 2OH– | -0,83 V |
| Bor (B) | B(OH)3 + 3H3O+ + 3e– ⇌ B + 6H2O | -0,89 V |
| Chrom (Cr) | Cr2+ + 2e– ⇌ Cr | -0,91 V |
| Niob (Nb) | Nb3+ + 3e– ⇌ Nb | -1,099 V |
| Vanadium (V) | V2+ + 2e– ⇌ V | -1,17 V |
| Mangan (Mn) | Mn2+ + 2e– ⇌ Mn | -1,18 V |
| Titan (Ti) | Ti3+ + 3e– ⇌ Ti | -1,21 V |
| Uran (U) | UO22+ + 4H+ + 6e– ⇌ U + 2H2O | -1,44 V |
| Zirconium (Zr) | Zr4+ + 4e– ⇌ Zr | -1,45 V |
| Hafnium (Hf) | Hf4+ + 4e– ⇌ Hf | -1,55 V |
| Uran (U) | U3+ + 3e– ⇌ U | -1,66 |
| Aluminium (Al) | Al3+ + 3e– ⇌ Al | -1,68V |
| Titan (Ti) | Ti2+ + 2e– ⇌ Ti | -1,77 V |
| Beryllium (Be) | Be2+ + 2e– ⇌ Be | -1,85 V |
| Scandium (Sc) | Sc3+ + 3e– ⇌ Sc | -2,077 V |
| Neodym (Nd) | Nd3+ + 3e– ⇌ Nd | -2,323 V |
| Magnesium (Mg) | Mg2++ 2e– ⇌ Mg | -2,38 V |
| Yttrium (Y) | Y3+ + 3e– ⇌ Y | -2,372 V |
| Cer (Ce) | Ce3+ + 3e– ⇌ Ce | -2,34 V |
| Lanthan (La) | La3+ + 3e– ⇌ La | -2,379 V |
| Natrium (Na) | Na+ + e– ⇌ Na | -2,71 V |
| Calcium (Ca) | Ca2+ + 2e– ⇌ Ca | -2,76 V |
| Strontium (Sr) | Sr2+ + 2e– ⇌ Sr | -2,889 V |
| Barium (Ba) | Ba2+ + 2e– ⇌ Ba | -2,90 V |
| Kalium (K) | K+ + e– ⇌ K | -2,92 V |
| Rubidium (Rb) | Rb+ + e– ⇌ Rb | -2,943 V |
| Caesium (Cs) | Cs+ + e– ⇌ Cs | -3,026 V |
| Lithium (Li) | Li+ + e– ⇌ Li | -3,04 V |
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Standardpotential
Grundsätzlich gibt ein Elektrodenpotential ( ) an, welche elektrische Spannung eine Elektrode liefert oder welche Spannung sie benötigt, um bei einer elektrochemischen Reaktion einen bestimmten Zustand aufrecht zu erhalten. Dabei müssen zwei Elektroden in Kontakt mit einem Elektrolyten stehen und es muss eine elektrische Spannung messbar
sein.
) an, welche elektrische Spannung eine Elektrode liefert oder welche Spannung sie benötigt, um bei einer elektrochemischen Reaktion einen bestimmten Zustand aufrecht zu erhalten. Dabei müssen zwei Elektroden in Kontakt mit einem Elektrolyten stehen und es muss eine elektrische Spannung messbar
sein.
Das Elektrodenpotential stellt eine der wichtigsten Größen zur Beschreibung einer Elektrode dar. Mit ihm kannst du so berechnen, welche elektrische Spannung beispielsweise Akkumulatoren oder Batterien liefern können oder welche Spannung eine Elektrolyse benötigt.
Das Standardpotential, Standardelektrodenpotential oder auch Normalpotential ( ) gibt an, wie groß die elektronenanziehende Kraft einer Elektrode ist. Gemessen wird das Standardpotential unter Standardbedingungen. Die Standardbedingungen geben an, dass die Konzentration der Ionen genau
) gibt an, wie groß die elektronenanziehende Kraft einer Elektrode ist. Gemessen wird das Standardpotential unter Standardbedingungen. Die Standardbedingungen geben an, dass die Konzentration der Ionen genau  betragen muss. Nur dann nimmt das Redoxpotential die in der Tabelle aufgelisteten Werte an.
betragen muss. Nur dann nimmt das Redoxpotential die in der Tabelle aufgelisteten Werte an.
Den Bezugspunkt für das Normalpotential stellt immer die Wasserstoffelektrode dar. Deshalb sind alle anderen Standardpotentiale die Spannungen, die gemessen werden, wenn links die Wasserstoffelektrode (Normalelektrode) und rechts die Elektrode des Redoxpaares zusammengeschlossen sind.
Standardpotential bei Metallen
Anhand der elektrochemischen Spannungsreihe kannst du auch erkennen, ob es sich um ein edles oder ein unedles Metall handelt. Grundsätzlich wird ein Metall als unedel bezeichnet, wenn sein Standardpotential niedriger ist als das von Wasserstoff. Je höher das Standardpotential, desto edler ist das Metall.
Die Ionen der Edelmetalle besitzen grundsätzlich eine höhere Bereitschaft, Elektronen aufzunehmen. Die Ionen der unedleren Metalle sind somit meist stärkere Reduktionsmittel, die eine höhere Bereitschaft haben, Elektronen abzugeben.
Anwendung
Du kannst die elektrochemische Spannungsreihe in vielen unterschiedlichen Zusammenhängen anwenden. Sie stellt unter anderem eine wichtige Grundlage zum Aufstellen und Berechnen der Nernst Gleichung dar.
In unserem zugehörigen Artikel zur Nernst Gleichung erklären wir dir, wie genau diese aussieht und was sie aussagt.
Wenn du die Standardpotentiale der Kathode und der Anode kennst, kannst du das Potential über folgende Formel berechnen:

Bei einem Wert von  läuft keine Reaktion ab und bei einem Wert von
läuft keine Reaktion ab und bei einem Wert von  läuft die Reaktion ab.
läuft die Reaktion ab.
Durch die elektrochemische Spannungsreihe kannst du unter anderem bestimmen, welche Redoxreaktionen freiwillig in der galvanischen Zelle ablaufen und welche sich nur durch eine Elektrolyse erzwingen lassen.
Elektrolyse
Bei einer Elektrolysezelle, die eine Anode aus Kupfer (Cu) und eine Kathode aus Zink (Zn) besitzt kannst du nun begründen, warum der Elektronenfluss von Anode zu Kathode nur gezwungenermaßen abläuft. Zuerst musst du das Standardpotential beider Elemente vergleichen. Kupfer ( ) besitzt ein Standardpotential von +0,35 V, während Zink (
) besitzt ein Standardpotential von +0,35 V, während Zink ( ein Standardpotential von -0,76 V aufweist.
ein Standardpotential von -0,76 V aufweist.
Diese Werte erhältst du aus der elektrochemischen Spannungsreihe. Da Zink unedler als Kupfer ist, ist es bestrebt Elektronen abzugeben. Elektronen fließen naturgemäß von der Anode zur Kathode. In diesem Fall wäre es also nötig, eine entsprechend hohe Spannung anzulegen, um die Elektrolyse zu starten.
Nun kannst du auch rechnerisch bestimmen, ob die Reaktion freiwillig abläuft oder erzwungen ist:


Da der Wert für 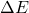 hier negativ ist, siehst du, dass die Reaktion nicht freiwillig ablaufen kann.
hier negativ ist, siehst du, dass die Reaktion nicht freiwillig ablaufen kann.
Mehr zur Elektrolyse, ihrer grundsätzlichen Funktionsweise und einigen Beispielen findest du in unserem zugehörigen Artikel .
Galvanische Zelle
Ein bekanntes Beispiel für eine galvanische Zelle ist das sogenannte Daniell Element. Dieses kannst du als Umkehrung der vorigen Elektrolyse betrachten. Beim Daniell Element besteht nun die Kathode aus Kupfer und die Anode aus Zink. Das Zink gibt seine Elektronen freiwillig ab, was auch der Verteilung von Anode und Kathode entspricht. Die entsprechenden Standardpotentiale kannst du wieder der elektrochemischen Spannungsreihe entnehmen.
Rechnerisch erhältst du:

Dabei ist 1,11 V das charakteristische Standardpotential des Daniell Elementes.
