Reduktion
Die Reduktion ist eine chemische Reaktion. Wie eine Reduktion definiert ist und wie sie abläuft, erklären wir dir hier anhand von Beispielen. Schau dir auch unser kurzes Video an!
Inhaltsübersicht
Was ist eine Reduktion?
In der Chemie verstehst du unter einer Reduktion eine Reaktion, bei der ein Stoff Elektronen aufnimmt. Er wird also reduziert. Durch die Elektronenaufnahme verringert sich die formale Ladung des Stoffes — die sogenannte Oxidationszahl.
Aber woher bekommt der Stoff eigentlich die Elektronen? Sie erhält er aus der Gegenreaktion zur Reduktion — der Oxidation. Beide Teilprozesse laufen immer gemeinsam ab. Du bezeichnest sie zusammen als Redoxreaktion .
Die Reduktion ist eine chemische Reaktion, bei der ein zu reduzierender Stoff Elektronen aufnimmt. Der Stoff wird dabei von einem Reduktionsmittel (Stoff, der Elektronen abgibt) reduziert.
Wie läuft eine Reduktion ab?
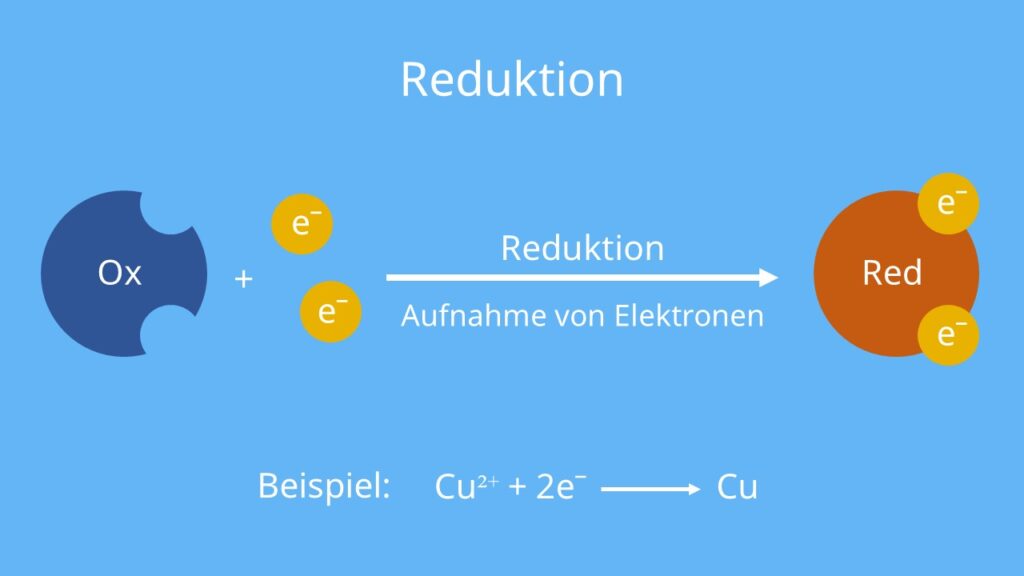
Bei einer Reduktion nimmt ein Stoff (Ox für Oxidationsmittel ) also Elektronen auf. Dabei handelt es sich um Elektronen, die ein anderer Stoff (Red für Reduktionsmittel) bei der Oxidation abgegeben hat.
Der Buchstabe n steht hier für die Anzahl der aufgenommenen Elektronen (1,2,3 …).
Die allgemeine Reduktionsgleichung kannst du deshalb so formulieren:
Ox + n e–  Red
Red
Merke: Bei einer Reduktion erfolgt eine Aufnahme von Elektronen und damit eine Verringerung der Oxidationszahl. Bei einer Oxidation findet eine Abgabe von Elektronen statt und daher eine Erhöhung der Oxidationszahl.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Beispiel einer Reduktion
Betrachten wir für die Reduktion am besten ein kleines Beispiel:
Stellst du einen Eisennagel in eine wässrige Kupfersulfatlösung (CuSO4), kannst du nach einiger Zeit einen rotbraunen Belag auf dem Nagel beobachten. Dabei handelt es sich um metallisches Kupfer. Die Kupfer-Ionen (Cu2+) in der Lösung haben Elektronen (2 e–) aufgenommen. Sie wurden also zu Kupfer (Cu) reduziert.
Die Reaktionsgleichung für die Reduktion lautet:
Cu2++ 2 e–  Cu
Cu
Hier kannst du auch gut das Absinken der Oxidationszahl erkennen: Die Kupfer-Ionen (Cu2+) haben die Oxidationszahl +2, elementares Kupfer (Cu) die Oxidationszahl 0.
Beachte: Die Elektronen für die Reduktion stammen hier vom Eisen (Fe). Eisen gibt nämlich 2 Elektronen ab und wird zu Eisen-Ionen (Fe2+) oxidiert.
Definitionen der Reduktion
Neben der modernen Definition, dass die Reduktion eine Elektronenaufnahme / Verringerung der Oxidationszahl ist, gibt es noch zwei weitere Definitionen, nämlich:
- die Reduktion als Abgabe von Sauerstoff
- die Reduktion als Aufnahme von Wasserstoff
Beachte: Bei beiden Definitionen werden natürlich trotzdem zusätzlich noch Elektronen aufgenommen.
Reduktion als Abgabe von Sauerstoff
Früher verstanden Wissenschaftler die Reduktion als die Abgabe von Sauerstoff. Das heißt, dass bei der Reaktion Sauerstoff frei wird. Schauen wir uns hierzu drei Beispiele an:
Beispiel 1: Bei der Reduktion von rotem Quecksilberoxid (HgO) zu Quecksilber (Hg) wird Sauerstoff abgespalten.
2 HgO  2 Hg + O2
2 Hg + O2
Natürlich nimmt hier das Quersilber-Ion (Hg2+) zusätzlich zwei Elektronen auf und wird zu Quersilber (Hg) reduziert.
Beispiel 2: Ein weiteres Beispiel ist die Reduktion von Kupferoxid (CuO) zu metallischem Kupfer (Cu). Hier ist Wasserstoff als Reduktionsmittel beteiligt und entzieht dem Kupferoxid Sauerstoff.
Bei der Reaktion wurde also aus einem schwarzen Pulver kupferfarbenes, festes Material.
CuO + H2 + 2 e–  Cu + H2O
Cu + H2O
Das Kupfer-Ion (Cu2+) im Kupferoxid nimmt zwei Elektronen auf. Es hat deshalb vor der Reaktion eine Oxidationszahl von +2 und nach der Reaktion ist sie 0.
Beispiel 3: Du kannst Kupfer aber auch herstellen, indem du Kupferoxid mit Kohlenstoff (C) erhitzt. Dabei dient Kohlenstoff als Reduktionsmittel.
2 CuO + C + 2 e–  2 Cu + CO2
2 Cu + CO2
Auch hier nimmt das Kupfer-Ion zwei Elektronen auf. Die Oxidationszahlen für Kupfer sind nämlich dieselben wie bei der Reduktion mit Wasserstoff: Also vor der Reaktion +2 und nachher 0.
Reduktion als Aufnahme von Wasserstoff
In der organischen Chemie und der Biochemie wird die Reduktion gerne als die Aufnahme von Wasserstoffatomen definiert.
Beachte: Auch hier werden aber trotzdem zusätzlich noch Elektronen übertragen.
Vor allem in Stoffwechselvorgängen in deinem Körper findet häufig eine solche Reduktion durch Übertragung von Wasserstoff statt.
Beispiel: Reduktion Aldehyd
Schauen wir uns das Beispiel der Reduktion eines Aldehyds an.
Aldehyde können durch Aufnahme von Wasserstoff und Elektronen zu Alkoholen reduziert werden. Betrachten wir dabei das Acetaldehyd, das du auch Ethanal nennst. Durch Elektronenaufnahme wird es zu Ethanol reduziert:
Wasserstoff (H2) nimmt die Rolle als Reduktionsmittel – also sozusagen als Antreiber der Reduktion – ein. Nur deshalb kann die Reaktion auch stattfinden. Die Oxidationszahl des C-Atoms vom Aldehyd war erst +1 und nach der Reaktion -1. Daran kannst du erkennen, dass es zwei Elektronen aufgenommen hat.
Wenn du nicht mehr weißt, wie du die Oxidationszahlen bestimmen kannst, schau dir unser Video dazu an!
Expertenwissen: Reduktionsarten in der Chemie
In der Chemie gibt es viele Reduktionen, die nach bekannten Chemikern benannt sind. Wir haben ein paar für dich aufgelistet:
- Clemmensen-Reduktion: benannt nach Erik Christian Clemmensen; Ketone und Aldehyde können durch Zink in Salzsäure zu Alkanen reduziert werden.
- Wolff-Kishner-Reduktion: genau wie Clemmensen-Reduktion, aber sie findet nicht in einer Säure , sondern in einer Base statt; benannt nach Ludwig Wolff und Nikolai Kishner.
- Luche-Reduktion: von Jean-Louis Luche entdeckt; selektive Reduktion mit NaBH4 (Natriumborhydrid) von Ketonen und Aldehyden.
- Birch-Reduktion: Arthur Birch hat entdeckt, dass man Aromaten mit Alkalimetallen (z.B. Natrium, Lithium) in nicht-aromatische Verbindungen reduzieren kann.
- Grignard-Reduktion: tritt als Nebenreaktion bei der von Victor Grignard entdeckten Grignard-Reaktion auf; sterisch (räumlich) gehinderte Ketone können hier zu Alkoholen reduziert werden.
Oxidation Reduktion
Fassen wir noch einmal zusammen:
- Bei der Reduktion werden von einem Stoff ein oder mehrere Elektronen aufgenommen. Deshalb kannst du ihn als Elektronenakzeptor bezeichnen.
- Die Elektronen, die der zu reduzierende Stoff aufnimmt, kommen aus dem Gegenprozess der Reduktion — der Oxidation. Bei der Oxidation gibt nämlich ein Stoff Elektronen ab.
Die Gesamtreaktion aus Oxidation und Reduktion bezeichnest du als Redoxreaktion.
Schau dir jetzt noch unser Video zur Oxidation an, damit du über beide Teilreaktionen der Redoxreaktion Bescheid weißt!