Oxidationszahlen bestimmen
Um eine Redoxreaktion aufzustellen, musst du die Oxidationszahlen bestimmen können. Wie du sie bestimmst und was du dabei beachten musst, zeigen wir dir hier und im Video.
Inhaltsübersicht
Was sind Oxidationszahlen?
Die Oxidationszahl ist die formale Ladung eines Atoms in einem Molekül oder Ion. Formale Ladungen sind gedachte Ladungen, die in der Chemie verwendet werden, um die Verteilung von Elektronen in Molekülen und Ionen zu beschreiben.
Du bestimmst die Oxidationszahl eines Atoms in Molekülen oder Ionen, indem du die Elektronegativitäten vergleichst. Die Summe aller Oxidationszahlen ist gleich der Gesamtladung eines neutralen Moleküls oder mehratomigen Ions.
Mit Oxidationszahlen erkennst und zeigst du hauptsächlich den Ablauf von Redoxreaktionen. Die Redoxreaktion erkennst du daran, dass sich die Oxidationszahl ändert:
- Oxidation: bei Abgabe von Elektronen steigt die Zahl
- Reduktion: durch Aufnahme von Elektronen sinkt die Zahl
In chemischen Reaktionsgleichungen schreibst du die Oxidationszahl über das Elementsymbol. Dafür verwendest du römische Ziffern (I, II, III, IV …).
Oxidationszahlen oder Oxidationsstufen sind hypothetische elektrische Ladungen, die Atome in Verbindungen erhalten, um den Grad ihrer Elektronenübertragung in chemischen Reaktionen zu bestimmen. Sie werden in römischen Zahlen über dem Elementsymbol angegeben.
Oxidationszahlen Grundlagen
Die Grundlage der Oxidationszahlen liegt in der Elektronegativität der Atome. Wenn Atome mit unterschiedlicher Elektronegativität miteinander reagieren, werden die Bindungselektronen vom Atom mit dem höheren Wert angezogen. Die Oxidationszahl wird also dadurch bestimmt, je nachdem, wie viele Elektronen ein Atom anzieht.
Das Kohlenstoffatom (C) in einem Methanmolekül (CH4) hat zum Beispiel die Oxidationszahl -IV, da es eine höhere Elektronegativität hat als die vier umliegenden Wasserstoffatome (H). Deshalb zieht es die Elektronen der Einfachbindungen zu sich, wodurch die Oxidationszahl zustande kommt.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Grundregeln der Oxidationszahlen
Bei der Bestimmung von Oxidationszahlen sind folgende Grundregeln wichtig:
- Die Oxidationszahl von Atomen im elementaren Zustand ist gleich null (0).
- Bei einatomigen Ionen ist die Oxidationszahl gleich der Ionenladung; das Chloridanion (Cl–) hat zum Beispiel die Oxidationszahl -I.
- Für mehratomige Ionen gilt, dass die Gesamtladung des Ions der Summe der Oxidationszahlen entspricht.
- Die Summe der Oxidationszahlen eines Moleküls ist gleich null (0).
- In kovalenten Verbindungen bestimmst du die Oxidationszahl, indem du die Elektronegativitäten vergleichst; die Bindungselektronen werden dem elektronegativeren Atom zugeordnet.
Das Plus besagt hier, dass das Natriumkation eine positive Ladung hat und das Minus, dass das Chloridanion eine negative Ladung trägt.
Oxidationszahlen Spezialfälle
Neben den generellen Regeln zur Bestimmung der Oxidationszahlen sind einige Elemente Spezialfälle. Häufig haben sie immer die gleiche Oxidationszahl, an die sich die Oxidationszahlen der anderen Elemente anpassen.
1. Fluor und andere Halogene
Das Fluoratom hat die höchste Elektronegativität und zieht daher die Bindungselektronen stärker zu sich. Folglich hat es immer die Oxidationszahl -I.
+I -I

Die meisten anderen Halogene haben ebenfalls eine hohe Elektronegativität und haben daher in den allermeisten Fällen auch die Oxidationszahl -I.
+I-I +I-I +I-I



2. Sauerstoff
Sauerstoff hat in den meisten Verbindungen die Oxidationszahl -II; Ausnahmen davon sind die Hyperoxide (O2--Ion; Oxidationszahl: -0,5) und Peroxide (O22--Ion, Oxidationszahl -I).
+VI-II +I -I +I -0,5



3. Metalle
Metalle haben in ionischen Verbindungen immer eine positive Oxidationszahl, da sie elektropositiv sind. Die Oxidationszahl entspricht meist der Nummer der Hauptgruppe.
+I -I +III-I +II-I



4. Wasserstoff
Wasserstoff hat fast immer die Oxidationszahl +I. Eine Ausnahme ist, wenn Wasserstoff Verbindungen mit Metallen eingeht. Sie nennst du auch Metallhydride. Dort hat der Wasserstoff die Oxidationszahl -I .
+I-I +I-II +I-I



Tipp: Wenn du also die Oxidationszahlen in einem großen Molekül bestimmen musst, versuche zuerst, diese Regeln anzuwenden und so einige Oxidationszahlen zu bestimmen. Die restlichen Werte kannst du mit den Grundlagen bestimmen.
Oxidationszahlen bei großen Molekülen bestimmen
Vor allem für kovalente Verbindungen, wie Kohlenwasserstoffe oder Verbindungen, bei denen du dir unsicher sein könntest, bietet sich eine grafische Bestimmung der Oxidationszahlen an. Auch bei ihr gelten die grundlegenden Regeln.
Schau dir dazu die graphische Bestimmung an einem Ethanol-Molekül an:
Zeichne als Erstes die Strukturformel deiner Verbindung mit allen Bindungen.
Nun schlage für jedes einzelne Element in der Verbindung im Periodensystem nach, welche Elektronegativitäten sie haben. Eine übersichtliche Tabelle haben wir hier für dich zusammengestellt.
Vergleiche dann für jede Bindung die Elektronegativitäten der Bindungspartner miteinander. Übertrage die Bindungselektronen demjenigen Bindungspartner zu, der die höhere Elektronegativität hat. Falls beide dieselbe Elektronegativität haben, teilen die Partner sich die Bindungselektronen.
Jetzt summierst du für jedes Atom in der Verbindung die Elektronen, die es nach der Zuweisung hat.
Abschließend ziehst du von der Valenzelektronenzahl jedes Atoms die Elektronenzahl aus dem vorigen Schritt ab. Daraus erhältst du die Oxidationszahl.
Gut zu wissen: Wie im Bild beim Kohlenstoff zu sehen ist, haben die Atome vom selben Element in einem Molekül nicht immer die gleiche Oxidationszahl. Sie ist also abhängig von der Molekülstruktur und den Bindungspartnern.
Oxidationszahlen bestimmen Übungen mit Lösungen
Hier noch ein paar weitere Beispiele, um die Grundregeln noch ein bisschen mehr zu vertiefen:
Bariumoxid:  (Ba= +II; O= -I)
(Ba= +II; O= -I)
Braunstein:  (Mn= +IV; O= -II)
(Mn= +IV; O= -II)
Hydroxid:  (O= -II; H= +I)
(O= -II; H= +I)
Kaliumpermanganat:  (K= +I; Mn= +VII; O= -II)
(K= +I; Mn= +VII; O= -II)
Phosphorsäure:  (H= +I; P= +V; O= -II)
(H= +I; P= +V; O= -II)
Thiosulfat:  (S= +V; O= -II)
(S= +V; O= -II)
Wasser:  (H= +I; O= -II)
(H= +I; O= -II)
Wasserstoffperoxid: 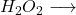 (H= +I, O= -I)
(H= +I, O= -I)
Oxidationszahlen Tabelle
Hier kannst du noch die gängigen Oxidationszahlen einiger wichtiger Elemente finden:
| Element | Elementsymbol | Oxidationszahlen |
| Lithium | Li | +I |
| Natrium | Na | +I, -I |
| Kalium | K | -I, +I |
| Wasserstoff | H | +I, -I |
| Beryllium | Be | +II |
| Magnesium | Mg | +II |
| Kalzium | Ca | +II |
| Bor | B | +III |
| Aluminium | Al | +III |
| Kohlenstoff | C | -IV, -III, -II, -I, 0, +I, +II, +III, +IV |
| Silizium | Si | -IV, -II. -I, +II, +IV |
| Stickstoff | N | -III, -II, -I, , 0, +I, +II, +III, +IV, +V |
| Phosphor | P | -III, -II, -I, 0. +I, +II, +III, +IV, +V |
| Sauerstoff | O | -II, -I, +I, +II |
| Schwefel | S | -II, -I, 0, +I, +II, +III, +IV, +V, +VI |
| Fluor | F | -I |
| Chlor | Cl | -I, +I, +III, +IV, +V, +VII |
| Brom | Br | -I, +I, +III, +V, +VII |
| Iod | I | -I, +I, +III, +V, +VII |
| Helium | He | 0 |
| Neon | Ne | 0 |
| Argon | Ar | 0 |
| Eisen | Fe | -II, -I, 0, +I,+II, +III. +IV, +V, +VI |
| Kupfer | Cu | +I, +II, +III, +IV |
| Gold | Au | -I, +I, +II, +III, +V |
| Silber | Ag | +I, +II, +III, +IV |
| Platin | Pt | -II, -I, 0, +II, +IV. +V, +VI |
| Cobalt | Co | -I, 0, +II, +III, +IV, V |
| Zink | Zn | +I, +II |
Oxidationszahlen — häufigste Fragen
(ausklappen)
Oxidationszahlen — häufigste Fragen
(ausklappen)-
Was ist der Unterschied zwischen Oxidationszahl und formaler Ladung?Die Oxidationszahl ist ein Rechenmodell: Alle Bindungselektronen werden dem elektronegativeren Partner zugeschlagen. Die formale Ladung verteilt hingegen Elektronen „fair“ in kovalenten Bindungen (Bindungselektronen werden geteilt). Beide Zahlen sind nur Hilfsgrößen — sie zeigen nicht die echte Ladung eines Atoms in einem Molekül.
-
Warum haben Halogene manchmal positive Oxidationszahlen?Sind Halogene an Sauerstoff gebunden (z. B. ClO−, ClO3−), erhält Sauerstoff aufgrund seiner höherer Elektronegativität die Bindungselektronen. Dadurch können Halogene wie Cl, Br, I positive Oxidationszahlen wie +1, +3, +5 oder +7 annehmen.
-
Kann Sauerstoff auch positive Oxidationszahlen haben?Ja, aber nur in seltenen Fällen. Sauerstoff hat eine positive Oxidationszahl, wenn er sich mit einem Element verbindet, das die Bindungselektronen stärker anzieht als er selbst. Ein Beispiel ist die Verbindung OF2, bei der Fluor die Elektronen stärker anzieht. In diesem Fall hat Sauerstoff die Oxidationszahl +2 statt der üblichen -2.
Redoxgleichungen
Jetzt weißt du alles über Oxidationszahlen. Um das Gelernte direkt anwenden zu können, schaue bei unserem Video zu den Redoxgleichungen vorbei!







