Redoxreaktionen
Redoxreaktionen finden in Batterien, Akkumulatoren oder auch in deinem Körper statt. Hier oder im kurzen Video zeigen wir dir, was eine Redoxreaktion ist und wie du Redoxgleichungen selbst aufstellen kannst.
Inhaltsübersicht
Was ist eine Redoxreaktion?
Eine Redoxreaktion ist eine chemische Reaktion, bei der Elektronen übertragen werden. Dabei gibt ein Reaktionspartner Elektronen ab, die ein anderer Partner aufnimmt. Die Elektronenabgabe nennst du Oxidation, die Elektronenaufnahme Reduktion.
Eine Redoxreaktion besteht also aus zwei Teilreaktionen:
- Oxidation: Stoff A gibt Elektronen (e–) ab. Du nennst ihn Reduktionsmittel oder Elektronendonator.
- Reduktion: Stoff B nimmt die Elektronen (e–) auf. Du bezeichnest ihn als Oxidationsmittel oder Elektronenakzeptor.
Redoxreaktion Definition
In der Chemie kannst du eine Redoxreaktion von Stoff A und Stoff B nach folgendem Reaktionsschema mit den Teilreaktionen formulieren:
Oxidation: A → A+ + e–
Reduktion: B + e– → B–
Zusammengefasst ergeben beide Teilreaktionen die Redoxreaktion:
Redoxreaktion: A + B → B– + A+
Stoff A ist hier das Reduktionsmittel. Das ist ein Stoff, der Elektronen abgibt. Dabei reduziert er einen anderen Stoff und wird selbst oxidiert.
Stoff B ist hier das Oxidationsmittel. Das ist ein Stoff, der Elektronen aufnimmt. Dadurch oxidiert er einen anderen Stoff und wird selbst reduziert.
Merke: Die Oxidation geschieht dabei meistens exotherm , also unter der Abgabe von Wärmeenergie. Sind Oxidation und Reduktion räumlich voneinander getrennt, kannst du durch den Elektronenfluss Strom erzeugen. So funktioniert eine galvanischen Zelle .
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Redoxreaktion aufstellen
In der Schule oder im Studium bekommst du häufig die Aufgabe, eine Redoxgleichung aufzustellen.
Wir haben für dich ein einheitliches Vorgehen erstellt, mit dem du immer zum Ziel kommst.
- Bestimmen der Oxidationszahlen
- Bestimmen der Teilreaktionen (Oxidation, Reduktion)
- Einzeichnen der übertragenen Elektronen
- Ladungsausgleich
- Stoffausgleich
- Ausgleich der Elektronen
- Addition der Teilgleichungen und Kürzen der Gesamtgleichung
Hinweis: Nicht bei jeder Redoxgleichung musst du alle Teilschritte durchführen!
Wenn du die Grundlagen einer Redoxreaktion einfach und kompakt erklärt bekommen willst, ist unser extra Beitrag dazu genau das Richtige für dich.
Redoxreaktion Beispiel
Schauen wir uns ein Beispiel für eine Redoxreaktion an: Zuerst betrachten wir die Gesamtreaktion, die wir dann in die Teilreaktionen aufteilen.
Hier reagiert Eisen(III)-oxid (Fe2O3) mit Aluminium (Al) zu Eisen (Fe) und Aluminiumoxid (Al2O3).
Fe2O3 + 2 Al → 2 Fe + Al2O3
An der Reaktionsgleichung kannst folgendes erkennen:
- Eisen(III)-oxid gibt seinen Sauerstoff an Aluminium ab.
- Die Eisenionen werden dabei reduziert.
- Aluminium wird hingegen durch die Aufnahme von Sauerstoff oxidiert.
Schauen wir uns jetzt die Teilgleichungen an. Hier kannst du anhand der Elektronenübergänge erkennen, welcher Stoff oxidiert bzw. reduziert wird.
Die zwei Teilgleichungen sind:
Du sieht, dass zwei Aluminiumatome (Al) 6 Elektronen abgeben, die dann von zwei Eisenionen (Fe3+) aufgenommen werden:
- Die Reaktion von Aluminium ist die Oxidation.
- Die Reaktion der Eisenionen ist die Reduktion.
Reduktions- und Oxidationsmittel
Oxidationsmittel sind in der Regel Elemente, die eine hohe Elektronegativität besitzen. Sie ‚wollen‘ somit Elektronen stark an sich ziehen. Generell gelten die Elemente der 6. und 7. Hauptgruppe als starke Oxidationsmittel. Das sind zum Beispiel Sauerstoff oder die Halogene Fluor oder Chlor.
Folglich sind Elemente, die gerne Elektronen abgeben, gute Reduktionsmittel. Das sind vor allem Alkali- und Erdalkalimetalle wie Natrium oder Magnesium. Aber auch andere unedle Metalle wie Aluminium und Zink sind gute Reduktionsmittel.
Redoxreaktion aufstellen Beispiel 1
Hier zeigen wir dir an einem Beispiel, wie du eine Redoxreaktion aufstellen kannst.
Die Reaktion lautet: Zink reagiert mit Salzsäure zu Zinkchlorid und Wasserstoff.
Stelle zuerst die Gesamtreaktion auf. Sie sieht so aus:
Zn + 2HCl → ZnCl2 + H2
Nun kannst du mit unseren 7 Teilschritten die Redoxgleichung aufstellen:
Schritt 1: Bestimmen der Oxidationszahlen
Als erstes bestimmst du die Oxidationszahlen der beteiligten Stoffe. Dabei handelt es sich sozusagen um die formale Ladung eines Stoffes.
Das bedeutet:
- Wenn ein Stoff ungeladen ist, müssen sich die einzelnen Oxidationszahlen auf null addieren.
- Handelt es sich um Ionen, ergibt die Summe der Oxidationszahlen immer die Ladung des entsprechenden Ions (Beispiel: -1 für ein einfach geladenes Anion).
Reine Elemente haben deshalb immer die Oxidationszahl null (0) und Verbindungen sind insgesamt auch immer neutral. Am besten merkst du dir zwei wichtige Oxidationszahlen: Sauerstoff hat fast immer die Oxidationszahl minus zwei (-2) und Wasserstoff plus eins (+1).
Für mehr Regeln und Übungen zu den Oxidationszahlen schaue gerne bei unserem Beitrag dazu vorbei!
Wenden wir das nun auf unser Beispiel an:
- Elementares Zink (Zn) hat die Oxidationszahl null (0).
- Salzsäure (HCl): Wasserstoff hat die Oxidationszahl plus eins (+1), Chlor minus eins (-1). HCl ist damit insgesamt neutral.
- Elementarer Wasserstoff (H2) hat die Oxidationzahl null (0).
- Zinkchlorid (ZnCl2): Chlor hat jeweils die Oxidationszahl minus ein (-1). Zink muss folglich die Oxidationszahl plus zwei (+2) haben, damit Zinkchlorid insgesamt neutral ist.
Schritt 2: Bestimmen der Teilreaktionen
Nun kannst du mithilfe der Oxidationszahlen direkt die Teilreaktionen, also die Oxidation und Reduktion, bestimmen. Hier gilt nämlich:
- Bei einer Oxidation steigt die Oxidationszahl des beteiligten Stoffes.
- Bei einer Reduktion sinkt Oxidationszahl des beteiligten Stoffes.
Du kannst also am Beispiel direkt erkennen:
- Zink wird oxidiert. Das erkennst du daran, dass die hatte Oxidationszahl von 0 auf +2 steigt. Die Oxidationszahl wurde also um 2 größer.
- Wasserstoff wird reduziert. Die Oxidationszahl sinkt hier von +1 auf 0. Sie wurde also um 1 kleiner.
- Chlor behält seine Oxidationszahl (-1) und nimmt nicht an der Redoxreaktion teil.
Es gilt also:
- Oxidation: Zn reagiert zu Zn2+
- Reduktion: 2H+ reagiert zu H2
Hinweis: Wir berücksichtigen hier die Chloridionen (Cl–) zunächst nicht.
Schritt 3: Einzeichnen der übertragenen Elektronen
Nun erstellst du die vollständigen Teilgleichungen. Hier gibst du jeweils an, wie viele Elektronen abgegeben oder aufgenommen wurden. Um das herauszufinden, musst du einfach schauen, um wie viel sich die Oxidationszahl eines Stoffes jeweils geändert hat.
- Oxidation: Elementares Zink hat die Zahl 0 und wird auf +2 oxidiert. Zink hat also 2 Elektronen (e–) abgegeben.
- Reduktion: Die beiden einfach positiv geladenen Wasserstoffionen (H+) haben die Oxidationszahl +1. Sie werden zum neutralen Wasserstoffmolekül (H2) mit der Oxidationszahl 0 reduziert. Jedes Wasserstoffatom nimmt jeweils ein Elektron auf. Das sind zwei Elektronen insgesamt.
Du kannst dir merken, dass die abgegebenen Elektronen immer auf der rechten Seite der Teilgleichung stehen. Die aufgenommen Elektronen schreibst du immer auf die linke Seite der Teilgleichung.
Damit bekommst du die zwei Teilreaktionen der Redoxreaktion:
Schritt 7: Addition der Teilgleichungen und Kürzen der Gesamtgleichung
Du benötigst bei unserem Beispiel Schritt 4,5 und 6 nicht:
- Der Ladungsausgleich (Schritt 4) funktioniert auch ohne Hydroxid (OH–) oder Oxonium-Ionen (H3O+). Sie sind deshalb nicht an der Reaktion beteiligt. Darum ist die Reaktion auch unabhängig davon, ob sie in basischem oder saurem Milieu abläuft.
- Auch der Stoffausgleich (Schritt 5) mit Wasser fällt daher weg.
- Da auf beiden Seiten gleich viele Elektronen abgegeben und aufgenommen wurden, fällt auch der Elektronenausgleich (Schritt 6) weg.
Du kannst nun beide Teilgleichungen addieren. Alles was links vom Pfeil steht, schreibst du jeweils links und alles was rechts vom Pfeil steht, schreibst du rechts.
Zum Schluss kannst du noch die beiden Elektronen links und rechts rauskürzen.
Dadurch ergibt sich folgende Redoxreaktion:
Zn + 2 HCl → ZnCl2 + H2
Redoxreaktion aufstellen: Beispiel 2
Bei der nächsten Aufgabe kannst du einmal das komplette Vorgehen anwenden. Dafür haben wir dir auch ein extra Video gedreht, welches du hier verlinkt findest.
Die Redoxgleichung lautet: Kupferoxid reagiert mit Kohlenstoff zu elementarem Kupfer und Kohlenstoffdioxid.
Die Summengleichung siehst du hier:
CuO + C → Cu + CO2
Schritt 1: Bestimmen der Oxidationszahlen
Der erste Schritt ist die Bestimmung der Oxidationszahlen, um herauszufinden was unsere Oxidation bzw. Reduktion ist.
- Kohlenstoff ist elementar und hat somit die Oxidationszahl null (0)
- Kupferoxid (CuO): Sauerstoff hat die Oxidationszahl minus zwei (-2) und Kupfer folglich die plus zwei (+2).
- Auf der rechten Seite ist Kupfer elementar und hat die Oxidationszahl null (0).
- Kohlenstoffdioxid (CO2): Sauerstoff hat wieder die Oxidationszahl minus zwei (-2). Da wir zwei Sauerstoffatome haben, hat der Kohlenstoff jetzt die Oxidationszahl plus vier (+4) haben.
Schritt 2: Bestimmen der Teilreaktionen
Jetzt kannst du bestimmen, welche Teilreaktion die Reduktion und welche die Oxidation ist:
- Oxidation: Kohlenstoff wird oxidiert: Seine Oxidationszahl erhöht sich von 0 (C) auf +4 (CO2).
- Reduktion: Kupfer wird reduziert: Seine Oxidationszahl verringert sich von +2 (CuO) auf 0 (Cu).
Schritt 3: Einzeichnen der übertragenen Elektronen
Nun kannst du die Teilgleichungen mit den übertragenen Elektronen ausgleichen.
- Oxidation: Hier erhöht sich Oxidationszahl von Kohlenstoff um vier (4). Kohlenstoff gibt also auch 4 Elektronen ab.
- Reduktion: Hier verringert sich die Oxidationszahl von Kupfer um zwei (2). Kupfer (Cu2+) nimmt also 2 Elektronen auf.
Schritt 4: Ladungsausgleich
Jetzt erfolgt der Ladungsausgleich. Dafür musst du zuerst wissen, ob die Reaktion im Neutralen, im Basischen oder im Sauren abläuft.
- Für den neutralen und sauren Bereich gleichst du mit H3O+ Ionen aus.
- Im basischen Bereich verwendest du OH–-Ionen.
Wenn keine Angabe in der Aufgabe steht, gehe am besten vom Neutralen aus.
Verwende hier also Oxonium-Ionen (H3O+) für den Ausgleich. Dafür schaust du dir bei beiden Teilgleichungen die Ladungen auf der linken und auf der rechten Seite an.
- Oxidation: Hier hast du links eine Ladung von ‚Null‘ . Rechts hast du wegen den vier Elektronen eine Ladung von ‚minus 4‘. Du schreibst also auf die negativere, rechte Seite noch 4 H3O+ -Ionen dazu. Dadurch ist die Ladung auch null.
- Reduktion: Links hast du eine Ladung von minus zwei und rechts eine von null. Also müssen wir links mit 2 H3O+ -Ionen ausgleichen.
Oxidation: C → CO2 + 4 e– + 4 H3O+
Reduktion: CuO + 2 e–+ 2 H3O+→ Cu
Schritt 5: Stoffausgleich
Der nächste Schritt ist der Stoffausgleich. Er erfolgt immer mit Wasser. Du schaust dir hierfür für jede der beiden Teilgleichungen an, wie Wasserstoff und Sauerstoff auf der linken bzw. rechten Seite verteilt sind.
- Oxidation: Hier hast du rechts vier mal drei, also 12 Wasserstoffatome und sechs Sauerstoffatome. Links befinden sich gar keine Wasserstoff- oder Sauerstoffatome. Du musst also mit so vielen H2O Molekülen auffüllen, damit die beiden Seiten identisch sind. In unserem Fall brauchst du sechs Wassermoleküle. Damit hast du auf beiden Seiten die gleiche Menge von Atomen.
- Reduktion: Bei der Teilreaktion funktioniert das genauso. Links hast du sechs Wasserstoff- und drei Sauerstoffatome. Rechts musst du drei Wassermoleküle hinzufügen, damit deine Gleichung stimmt.
Schritt 6: Ausgleich der Elektronen
Im sechsten Schritt musst du noch dafür sorgen, dass beide Teilgleichungen dieselbe Anzahl an Elektronen aufweisen.
Das bekommst du ganz einfach hin, indem du die Reduktionsgleichung mit zwei multiplizierst. Deine beiden Gleichungen sehen nun so aus:
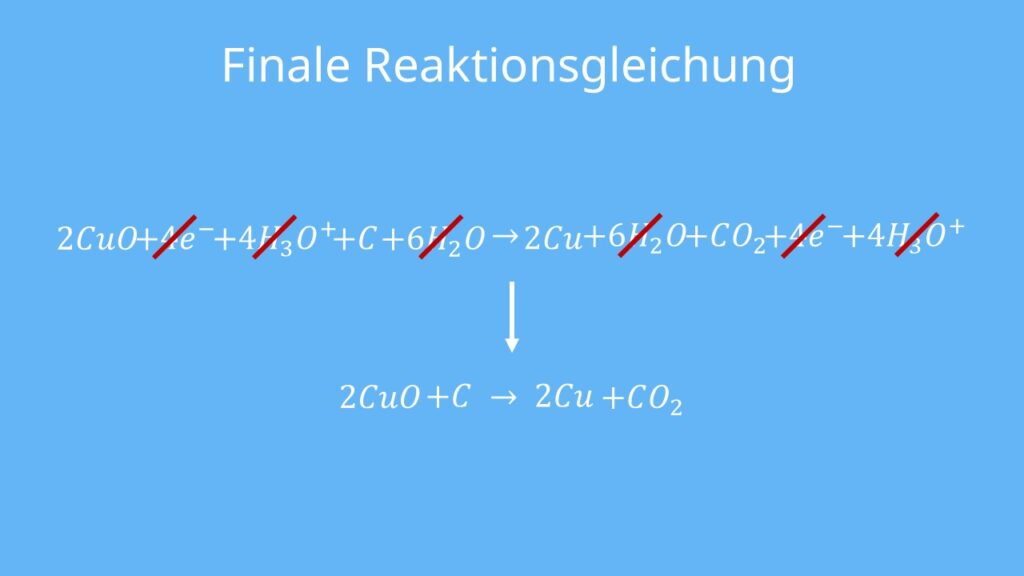
Schritt 7: Addition der Teilgleichungen und Kürzen der Gesamtgleichung
Als letzten Schritt musst du nur noch aus diesen Teilgleichungen eine einzige Gesamtgleichung machen. Das wichtigste dabei ist, dass du weißt, was auf welche Seite kommt. Edukte zu Edukten und Produkte zu Produkten. Also alles was mal auf der linken Seite einer Teilgleichung stand, muss auch auf der linken Seite der Gesamtgleichung stehen. Das sieht dann so aus:
Das wirkt jetzt etwas kompliziert, aber wie auch in der Mathematik kannst du hier einiges kürzen — nämlich alles, was auf beiden Seiten gleich ist.
Die finale Reaktionsgleichung ist dann:
Mit diesem Vorgehen kannst du jede Reaktionsgleichung aufstellen.
Redoxreaktionen Übungen
Willst du es nun einmal selbst ausprobieren? Dann schau in unserem Beitrag „Redoxreaktionen Übungen “ vorbei! Hier findest kannst du üben verschiedene Redoxgleichungen aufzustellen und dann mit den Lösungen zu den Beispielen abgleichen.