Ionengitter
Alles, was du über Ionengitter wissen musst, erfährst du hier und im Video !
Inhaltsübersicht
Ionengitter einfach erklärt
Ein Ionengitter ist eine gleichmäßige Aufstellung, die aus positiv (Kationen) und negativ (Anionen) geladenen Ionen besteht. Durch ihre entgegengesetzten Ladungen ziehen sie sich gegenseitig an und bilden eine Struktur, die wie ein Gitter aussieht: das Ionengitter. Die Anordnung der Ionen und ihre Anziehungskraft machen das Ionengitter äußerst stabil.
Die Ladungen der Ionen wirken in alle Richtungen. Somit zieht ein Ion nicht nur ein weiteres, sondern direkt mehrere andere Ionen an. Stoffe, in denen Ionengitter vorkommen, sind Salze. Dazu gehört zum Beispiel Natriumchlorid (NaCl).
Ionen sind Atome oder Moleküle, die entweder mehr oder weniger Elektronen als ihre ursprüngliche Form haben. Dadurch sind sie geladen. Ionen entstehen unter anderem durch chemische Prozesse wie zum Beispiel Redox-Reaktionen. Ionen können positiv (Kationen) oder negativ (Anionen) geladen sein und sind die Grundlage für das Ionengitter.
Ionengitter — Bildung und Struktur
Ionengitter bilden sich, wenn sich die Atome eines Stoffs in Form von positiv und negativ geladenen Ionen miteinander verbinden.
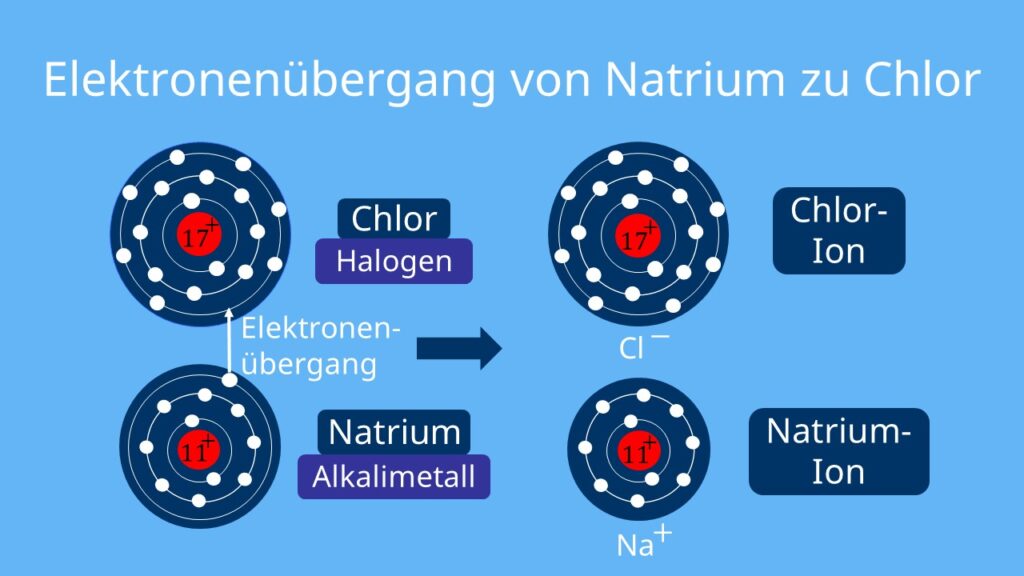
Der Grund für die Entstehung von Ionen ist die Oktettregel. Diese Regel besagt, dass jedes Atom im Schalenmodell acht Elektronen in der äußersten Schale haben muss, um ein stabiles Molekül zu bilden. So kommt es zum Beispiel bei Halogenen (siebte Hauptgruppe) häufig vor, dass sie sich das einzelne Außenelektron von Alkalimetallen (erste Hauptgruppe) zu sich ziehen.
Jetzt hat das Halogen acht Elektronen in der äußersten Schale und damit ein Elektron mehr als normalerweise. Dadurch entsteht eine negative Ladung. Das Alkalimetall, das jetzt ein Elektron weniger hat als sonst, ist nun positiv geladen.
Durch die verschiedenen Ladungen ziehen sich die Ionen gegenseitig an und bilden die Gitterstruktur. Sie wird von den sogenannten Ionenbindungen zusammengehalten. Die positiv geladenen Ionen bilden die Wände des Gitters, während die negativ geladenen Ionen die Lücken zwischen den Wänden füllen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Ionengitter — Eigenschaften
Aufgrund des Ionengitters weisen alle Salze sehr ähnliche Eigenschaften auf. Dazu gehören:
-
Stabilität:
Ionenbindungen zählen zu den stärksten Bindungen zwischen Atomen. Das macht das Ionengitter äußerst stabil und hart. Unter Druck lässt es sich nicht verformen, sondern zerspringt lediglich.
Der Grund dafür ist, dass durch den Druck gleich geladene Ionen immer mehr aneinander gedrückt werden. Da sich gleich geladene Teilchen allerdings abstoßen, bricht das Ionengitter und somit auch der Salzkristall, auseinander.
-
Hohe Schmelz- und Siedetemperaturen:
Die Stabilität ist auch der Grund für die hohen Schmelz- und Siedetemperaturen der Salze. Durch die starken Ionenbindungen lassen sich die Atome kaum bewegen. Möchte man jedoch einen Stoff schmelzen, muss man seine Atome in Bewegung bekommen.
Deshalb muss enorm viel Energie aufgebracht werden, um die Gitterstruktur zu lösen. Das Salz Natriumchlorid zum Beispiel verflüssigt sich erst bei 801°C.
-
Kristallstruktur:
Aufgrund der gleichmäßigen Anordnung der Ionen im Ionengitter, besitzen Salze immer eine Kristallstruktur. Auch wenn es unterschiedliche Strukturtypen gibt, haben sie in der Regel immer scharfe Kanten und glatte Flächen.
Interessant: Ein Ionengitter sieht für das bloße Auge in der Regel immer wie ein Kristall aus.
Strukturtypen
Salze haben zwar alle ein Ionengitter und somit ähnliche Eigenschaften, allerdings besitzen nicht alle die gleiche Struktur. Grundsätzlich kannst du alle Strukturtypen von Salzen in zwei Kategorien einteilen: die AB-Strukturen und die AB2-Strukturen.
AB-Strukturen
Die AB-Strukturen bilden einfache Gitter in verschiedenen Formen. Der Name erklärt die Anordnung der Ionen:
Es gibt die gleiche Anzahl an Ionen vom Element A sowie vom Element B. Somit ist ein Ion des Stoffs A von x Ionen des Stoffs B umgeben. Umgekehrt gilt das Gleiche.
Es gibt drei Arten von AB-Strukturen:
-
Tetraeder:
Hier wird ein Ion immer von vier Ionen eines anderen Elements umgeben.Ionengitter: Tetraeder
-
Oktaeder
Hier wird ein Ion immer von sechs Ionen eines anderen Elements umgeben.Ionengitter: Oktaeder
AB2-Strukturen
Die AB2-Strukturen haben ein anderes Ionenverhältnis als AB-Strukturen. Hier gibt es nämlich doppelt so viele Ionen vom Element A als vom Element B. Somit umgeben x Ionen B nur ein Ion A, umgekehrt umgeben jedoch 2 mal x Ionen A ein Ion B.
AB2-Strukturen kannst du allerdings nur in zwei Arten aufteilen:
Ionenbindung
Sehr schön! Jetzt weißt du alles Wichtige über Ionengitter. Ohne Ionenbindungen wären die Ionengitter nicht ansatzweise so stabil. Aber warum genau gehören Ionenbindungen zu den stärksten chemischen Bindungen? Das erklären wir dir in unserem Video dazu!