Anion
Was ist ein Anion und wie hängen sie mit Säurerestionen zusammen? Welche Typen von Anionen gibt es? Das erklären wir dir in dem folgenden Beitrag.
Um das Thema noch schneller zu verstehen, kannst du dir gerne unser Video dazu anschauen!
Inhaltsübersicht
Anion einfach erklärt
Das Anion (auch negativ geladenes Ion ) ist ein negativ geladenes Teilchen. Anionen können einerseits entstehen, wenn ein Atom oder ein Molekül Elektronen aufnimmt. Andererseits kann ein Anion auch dadurch entstehen, dass ein Atom oder ein Molekül Protonen abgibt.
Das Anion ist ein negativ geladenes Teilchen, welches bei Elektronenaufnahme oder Protonenaufnahme eines Atoms entsteht.
Der Name das Anions stammt daher, das Anionen bei einer Elektrolyse an die Anode (Pluspol) wandern.
Anion Kation
Das Gegenstück zum Anion ist das Kation, welches positiv geladen ist. Anionen und Kationen kommen beide jeweils nie isoliert vor, sondern es existiert immer das jeweilige Gegenion.
Hier kannst du dir gerne unser Video zum Kation anschauen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Säurerestionen
Beim dissoziieren, also dem Zerfall einer Säure in ihre ionischen und atomaren Bestandteile, entsteht neben dem Proton das Säurerestion. Das Säurerestion ist dabei ein Anion.
HnA ⇌ n H+ + An-
Du hast bei der Dissoziation, bei dem deine Säure HnA ihre Protonen abgibt und sich ein Säurerestion An- bildet, immer das gleiche Schema. Beispiele für Säurerestionen sind beispielsweise die Säurereste Cl–, HSO4– und NO3– der Säuren HCl, H2SO4 und HNO3.
Anion verschiedener Elemente
Viele Elemente der 4. bis 7. Hauptgruppe können Anionen durch Elektronenaufnahme bilden. Die Triebkraft dafür ist das Erfüllen der Oktettregel für das Anion, also acht Valenzelektronen zu haben. Ein Atom A nimmt n Elektronen e– auf und es bildet sich das Anion An-.
A + n e– → An-
Es gibt auch viele Elementanionen, wie beispielsweise beim Peroxid oder Azid, die das gleiche Atom zweimal oder dreimal beinhalten, also binäre und ternäre Anionen. Bor, welches in der 3. Hauptgruppe ist, bildet ebenfalls Anionen, nämlich Boride. Gleiches gilt für das Wasserstoff, welches Hydride bildet, die oft Verbindungen mit Kationen der Alkalimetalle bilden. Für alle Elementanionen lautet die Endung für die Nomenklatur -id. Wir haben für euch mal die wichtigsten Anionen tabellarisch festgehalten.
| 4. Hauptgruppe | 5. Hauptgruppe | 6. Hauptgruppe | 7. Hauptgruppe | Übrige |
| Methanid (C4-) Acetylid (C22-) | Nitrid (N3-) Azid (N3–) | Oxid (O2-) Peroxid (O2–) | Fluorid (F–) | Hydrid (H–) |
| Silicid (Si4-) | Phosphid (P3-) | Sulfid (S2-) Disulfid (S22-) | Chlorid (Cl–) | Borid (Bx-) |
| Bromid (Br–) | ||||
| Iodid (I–) |
Molekulare Anionen
Die wichtigen molekularen Anionen sind die Sauerstoffhaltigen Anionen oder auch Oxoanionen genannt. Du hast bei solchen Anionen ein zentrales Atom, welches kovalent zu Sauerstoffatomen gebunden ist. In der Regel sind dies maximal vier Sauerstoffatome. Es gibt darüber hinaus noch weitere wichtige molekulare Anionen, die Stickstoff beinhalten wie das Cyanid (CN–), das Amid (NH2–) oder das Thiocyanat (SCN−).
Nomenklatur von Oxoanionen
Die Nomenklatur der Oxoanionen kannst du dir mit folgender Tabelle ganz leicht merken. Du brauchst dir für die Nomenklatur jeweils nur das Elementanion zu merken. Deine Elementanion hat immer die Endung -at. Fügst du von dem Elementanion ausgehend ein Sauerstoffatom hinzu, landest du bei dem Perelementanion, die ebenfalls die Endung -at trägt. Entfernst du ein Sauerstoffatom von deinem Elementanion, kommst du zum Elementigen Anion mit der Endung -it. Bei der Entfernung von zwei Sauerstoffatomen von dem Elementanion landest du bei dem Hypoelementigen Anion, ebenfalls mit der Endung -it.
Schauen wir uns das eben am besten am Beispiel des Elementanion Chlorat (ClO3–) an. Das Perchlorat (ClO4–) hat ein Sauerstoffatom mehr als das Chlorat. Entfernst du vom Chlorat ein Sauerstoffatom, erhälst du das Chlorit (ClO2–). Beim Entfernen von zwei Sauerstoffatomen vom Chlorat landest du beim Hypochlorit (ClO–). Wir haben die wichtigsten Oxoanionen in der Tabelle für dich mal dargestellt.
| Klasse | 3. Hauptgruppe | 4. Hauptgruppe | 5. Hauptgruppe | 6. Hauptgruppe | 7. Hauptgruppe |
| Perelementanion | Perchlorat (ClO4–) Perbromat (BrO4–) Periodat (IO4–) | ||||
| Elementanion | Borat (BO33-) | Carbonat (CO32-) | Nitrat (NO3–) Phosphat (PO43-) | Sulfat (SO42-) | Chlorat (ClO3–) Bromat (BrO3–) Iodat (IO3–) |
| Elementiges Anion | Nitrit (NO2–) Phosphit (PO33-) | Sullfit (SO32-) | Chlorit (ClO2–) Bromit (BrO2–) | ||
| Hypoelementiges Anion | Hypochlorit (ClO–) Hypobromit (BrO–) |
Anionen, die ein Proton in einer Säure-Base-Reaktion aufgenommen haben, wird im Namen das Präfix „Hydrogen-“ vorangestellt. Somit heißt das HPO42--Ion beispielsweise Hydrogenphosphat.
Oxoanionen von Nebengruppenelementen, wie beispielsweise das Chromat (CrO4–), das Dichromat (Cr2O72-) oder das Permanganat (MnO4–), dienen oft als starke Oxidationsmittel.
Organische Anionen
Schauen wir uns als letztes die organischen Anionen an, von denen es zahlreiche gibt. Bei organischen Anionen handelt es sich, wie du an den Strukturformeln mit den -COOH-Gruppen erkennst, meist um ein Carboxylate.
Das Acetat ist das Anion der Essigsäure . Das Gleichgewicht liegt auf Seiten der Essigsäure, da diese eine schwache Säure ist. Schwache Säuren haben nur eine geringe Tendenz, ihr Proton abzugeben. Die Essigsäure findest du beispielsweise stark verdünnt im Speiseessig vor.
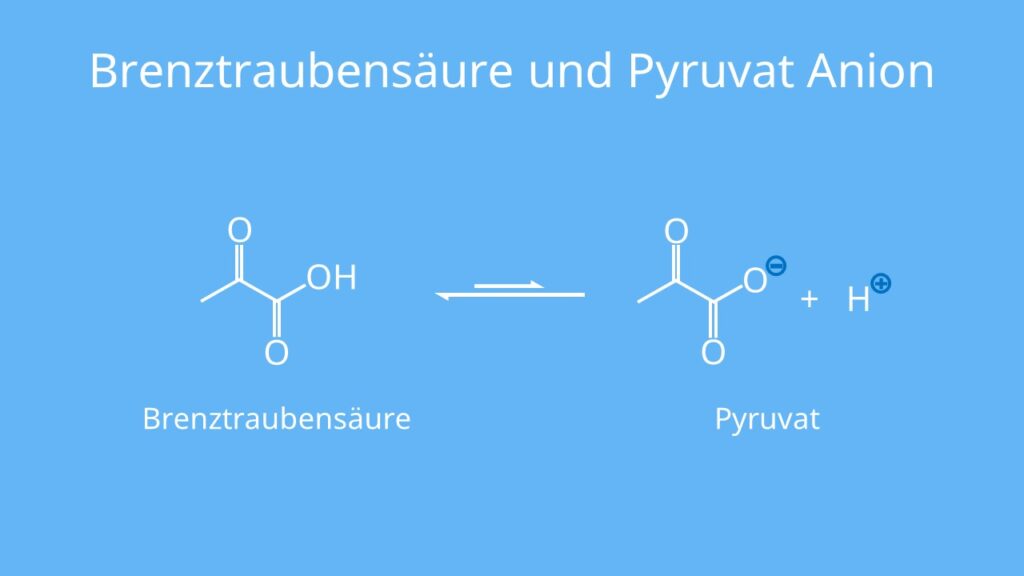
Aus der Biochemie kennst du vielleicht schon das Pyruvat, das Anion der Brenztraubensäure. Pyruvat spielt dabei im körpereigenen Stoffwechsel eine zentrale Rolle. und ist ebenfalls eine schwache Säure.