Chlorwasserstoff
Chlorwasserstoff ist ein farbloses Gas. In diesem Beitrag lernst du seine Eigenschaften, Herstellung und Verwendung kennen. Schau dir direkt unser Video dazu an!
Inhaltsübersicht
Was ist Chlorwasserstoff?
Chlorwasserstoff (auch Wasserstoffchlorid, Hydrogenchlorid; engl. hydrogen chloride) besteht — wie dir der Name verrät — aus den Elementen Chlor (Cl) und Wasserstoff (H). Er hat daher die Summenformel HCl. Es handelt sich dabei um eine gasförmige Verbindung.
Mit HCl musst du immer vorsichtig umgehen, da es deine Haut, Augen, Schleimhäute und Atmungsorgane stark reizen kann.
In der chemischen Industrie wird das Gas hauptsächlich zur Herstellung von Salzsäure (HCl(aq)) oder Chloriden (Cl–) verwendet.
Merke: Chlorwasserstoff und Salzsäure sind NICHT dasselbe! Salzsäure ist Chlorwasserstoff gelöst in Wasser.
Chlorwasserstoff Eigenschaften
Im Folgenden haben wir dir einige physikalische und chemische Eigenschaften von Chlorwasserstoff aufgelistet:
- Molare Masse: Die molare Masse von HCl beträgt 36,46 g/ mol.
- Dichte : HCl hat eine Dichte von 1,64 g/cm3.
- Schmelzpunkt: Bei -114,8°C gefriert die Verbindung.
- Siedepunkt: HCl verflüssigt bei -85°C.
- Aussehen: Chlorwasserstoff ist ein farbloses Gas.
- Geruch: Er hat einen stechenden Geruch.
- Löslichkeit: Die Verbindung ist vollständig mischbar mit Wasser.
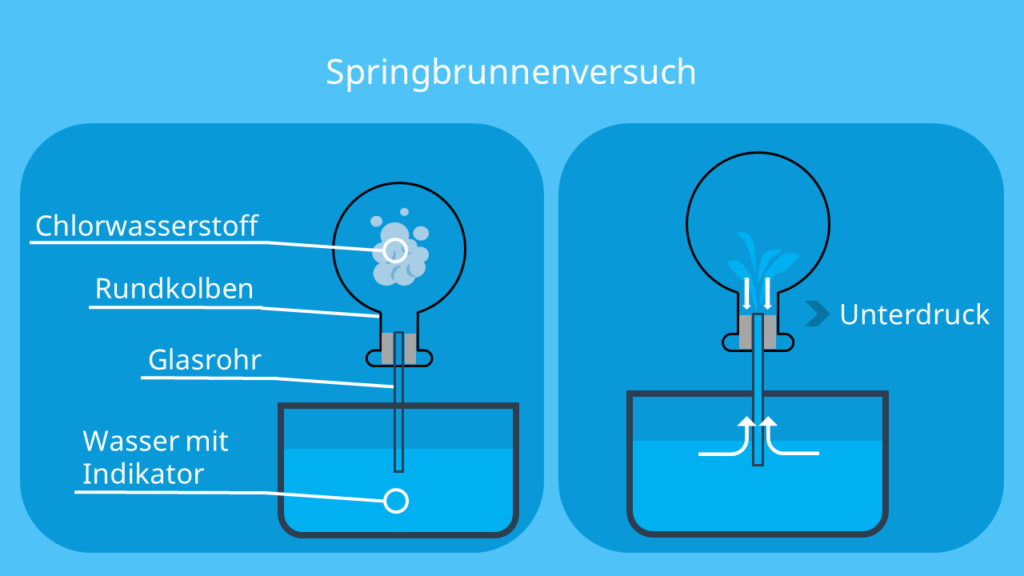
- Besonderheit: Füllst du das Gas in einen Rundkolben und verbindest ihn durch ein Glasrohr mit Wasser, bildet sich im Rundkolben eine Art Springbrunnen. Das Wasser steigt in den Kolben, weil sich Chlorwasserstoff sehr gut in Wasser löst. Dadurch entsteht ein Unterdruck im Kolben. Den Versuch bezeichnest du als Springbrunnenversuch.
Reaktionen
Bei der Reaktion von HCl mit Wasser wird Salzsäure (HCl(aq)) gebildet:
![Rendered by QuickLaTeX.com \[\ce{HCl + H2O -> H3O+ + Cl-}\]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-5fceed50264af0aab5f78ac6ef0a08a9_l3.png)
Befindet sich Chlorwasserstoff in einer Umgebung mit hohem Druck und einer Temperatur von etwa 200°C, kann es mit Acetylen (Ethin C2H2) reagieren. Hier entsteht dann Vinylchlorid (C2H3Cl):
![Rendered by QuickLaTeX.com \[\ce{C2H2 + HCl -> C2H3Cl}\]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-6bea38693e4a433691a882286857c7d9_l3.png)
Es findet also eine Chlorierung von Acetylen statt. Auch Alkane können chloriert werden. Lässt du Methan (CH4) mit dem Gas und Sauerstoff (O2) reagieren, erhältst du Chlormethan (CH3Cl) und Wasser (H2O):
![Rendered by QuickLaTeX.com \[\ce{2 CH4 + 2 HCl + O2 -> 2 CH3Cl + 2 H2O}\]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-1ea6d436609f2aeb2c4a8ef66645a4e8_l3.png)
Auch an aromatische Verbindungen wie Benzol (C6H6) kannst du mithilfe von HCl ein Chloratom addieren. Dabei reagiert Benzol mit Chlorwasserstoff und Formaldehyd (CH2O) zu Benzylchlorid (C7H7Cl) und Wasser.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Toxizität und biologische Bedeutung
Solltest du mit dem HCl-Gas hantieren, musst du sehr vorsichtig sein. Seine Dämpfe können nämlich deine Augen, Haut, Schleimhäute und Atmungsorgane reizen. Gelangt das Gas in deinen Kehlkopf, kann sich ein tödliches Kehlkopfödem bilden.
Liegt Chlorwasserstoff in hohen Konzentrationen vor, kann es auch in die Lunge eindringen. Dort kann dann ein Lungenödem entstehen, das zum Tode führen kann. Ob eine solche gefährliche Reaktion in deinem Körper stattfindet, hängt immer von der Menge des Gases ab.
Da sich HCl gut in der Mundschleimhaut löst, kann es auch deine Zähne angreifen.
Trotz allem ist HCl-Gas auch wichtig für deinen Körper. Er ist nämlich in Form der Salzsäure in deiner Magensäure enthalten. Sie ist dort bei der Zerkleinerung deiner Nahrung behilflich.
Chlorwasserstoff Herstellung
Du kannst das HCl-Gas auf unterschiedliche Arten gewinnen. Eine Möglichkeit ist die Reaktion der beiden Bestandteile des Gases — also Wasserstoff (H2) und Chlor (Cl2):
![Rendered by QuickLaTeX.com \[\ce{H2 + Cl2 -> 2 HCl}\]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-f5f254ebbcf8a246c2bab671d0f1afdd_l3.png)
Aber Vorsicht: Diese Reaktion kann vor allem unter Lichteinwirkung explosionsartig verlaufen!
Du kannst Chlorwasserstoff aber auch herstellen, indem du Natriumchlorid (NaCl) mit Schwefelsäure (H2SO4) reagieren lässt:
![Rendered by QuickLaTeX.com \[\ce{2 NaCl + H2SO4 -> 2 HCl + Na2SO4}\]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-3e1801a806d1697985a79f1511545e86_l3.png)
Daneben erhältst du auch Natriumsulfat (Na2SO4).
Chlorwasserstoff Verwendung
Das Gas wird hauptsächlich zur Herstellung anderer Stoffe genutzt. Dazu gehören:
- Salzsäure (HCl(aq))
- Chloride (Cl–)
- PVC (Polyvinylchlorid (C2H3Cl)n)
Chlorwasserstoff Salzsäure
Salzsäure ist also nicht dasselbe wie Chlorwasserstoff. Sie ist Chlorwasserstoff, der in Wasser gelöst ist. Worin sich die beiden Substanzen noch unterscheiden, erfährst du in unserem Video zur Salzsäure. Bis gleich!