Molares Volumen
Molares Volumen – Was ist das und wie hängt dieses Volumen mit dem idealen Gas zusammen? Wie berechnest du das molare Volumen? Genau das erklären wir dir in dem folgenden Beitrag.
Um das Thema noch schneller zu verstehen, kannst du dir gerne unser Video dazu ansehen!
Inhaltsübersicht
Molares Volumen einfach erklärt
Molares Volumen  (auch Molvolumen) bezeichnet das Volumen, welches ein Mol einer Substanz einnimmt. Die Einheit für das molare Volumen in der Chemie ist meist Liter pro Mol (
(auch Molvolumen) bezeichnet das Volumen, welches ein Mol einer Substanz einnimmt. Die Einheit für das molare Volumen in der Chemie ist meist Liter pro Mol ( ). Ein Mol sind dabei
). Ein Mol sind dabei  Teilchen, wobei du diese Zahl als Avogadro-Konstante
Teilchen, wobei du diese Zahl als Avogadro-Konstante
 bezeichnest.
bezeichnest.
Das Molare Volumen  bezeichnet das Volumen, das von
bezeichnet das Volumen, das von  Teilchen einer Substanz eingenommen wird.
Teilchen einer Substanz eingenommen wird.
Ein Mol eines Stoffes kann sich im Volumen sehr stark unterscheiden.
Molares Volumen berechnen
Schauen wir uns jetzt mal die Berechnung des Molaren Volumen an. Es gibt zwei Möglichkeiten zur Berechnung. Du benötigst zunächst einmal die Formel. Anschließend ist das molare Volumen eines idealen Gases interessant.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Molares Volumen Formel
Schauen wir uns mal zusammen die Formel an.
 oder
oder 
Du berechnest das molare Volumen, indem du das Volumen  in Liter (
in Liter ( ) durch die Stoffmenge in Mol (
) durch die Stoffmenge in Mol ( ) einer Substanz teilst. Ebenso kannst du die Molare Masse
) einer Substanz teilst. Ebenso kannst du die Molare Masse
 in Gramm pro Mol (
in Gramm pro Mol ( ) durch die Dichte
) durch die Dichte  in Gramm pro Liter (
in Gramm pro Liter ( ) einer Substanz teilen. Das Molare Volumen ist für alle Stoffe konstant.
) einer Substanz teilen. Das Molare Volumen ist für alle Stoffe konstant.
Molares Volumen ideales Gas
Gase wie Stickstoff, Sauerstoff oder Argon sind nahezu ideale Gase. Das „ideale Gas“ ist eine Modellvorstellung. Fasst du die genannten Gase unter dem Begriff des „idealen Gases“ zusammen, so verhält sich jedes der genannten Gase gleich. Damit hat auch jedes ideale Gas das gleiche molare Volumen.
 =
= 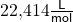
Das Molvolumen eines idealen Gases  oder auch das molare Normvolumen beträgt unter den Bedingungen
oder auch das molare Normvolumen beträgt unter den Bedingungen  und
und  immer
immer 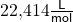 . Diese Bedingungen werden auch Normalbedingungen genannt und müssen definiert sein, da sich das Molvolumen mit der Temperatur und dem Druck ändert.
. Diese Bedingungen werden auch Normalbedingungen genannt und müssen definiert sein, da sich das Molvolumen mit der Temperatur und dem Druck ändert.
Molares Volumen Beispiele
Sehen wir uns zwei Beispiele zur Berechnung des molaren Volumens an.
Molares Volumen Sauerstoff
Berechnen wir in einem ersten Beispiel das Molvolumen des Sauerstoffs.
Du hast ein Volumen von  und eine Stoffmenge
von
und eine Stoffmenge
von  Sauerstoff gegeben und willst das molare Volumen berechnen? Dafür setzt du einfach deine Werte in die Formel zur Berechnung des molaren Volumen ein.
Sauerstoff gegeben und willst das molare Volumen berechnen? Dafür setzt du einfach deine Werte in die Formel zur Berechnung des molaren Volumen ein.

Das molare Volumen von Sauerstoff beträgt  . Du siehst, Sauerstoff kommt einem idealen Gas also sehr nahe.
. Du siehst, Sauerstoff kommt einem idealen Gas also sehr nahe.
Molares Volumen Wasser
Welches molare Volumen hat aber eigentlich Wasser? Du hast diesmal eine Molare Masse
von  und eine Dichte von
und eine Dichte von  . Beide Werte kannst du aus deinem Tafelwerk entnehmen. Du setzt deine Werte jetzt in die andere Formel zur Berechnung des molaren Volumen ein.
. Beide Werte kannst du aus deinem Tafelwerk entnehmen. Du setzt deine Werte jetzt in die andere Formel zur Berechnung des molaren Volumen ein.

Ein Mol Wasser nimmt mit  deutlich weniger Volumen ein als ein Mol Sauerstoff mit
deutlich weniger Volumen ein als ein Mol Sauerstoff mit  .
.
Molares Volumen Verbindungen
Stellen wir mal ein paar molare Volumina in einer Tabelle gegenüber.
| Name | Formelzeichen |  ![Rendered by QuickLaTeX.com [\mathsf{\frac{L}{mol}}]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-8949cb73cebd765857e4087b8c360439_l3.png) |
Aggregatzustand |
| Sauerstoff | O2 | 22,4 | Gasförmig |
| Stickstoff | N2 | 22,4 | Gasförmig |
| Wasser | H2O | 0,0181 | Flüssig |
| Ethanol | C2H6O | 0,0584 | Flüssig |
| Silber | Ag | 0,0103 | Fest |
Du siehst, dass die Gase ein deutlich größeres molares Volumen haben als die Flüssigkeiten. Noch geringer ist das molare Volumen eines Feststoffes, hier am Beispiel des Silber. Die Teilchen sind im Gas deutlich weiter voneinander entfernt als in der Flüssigkeit und nehmen somit mehr Platz ein. Im Feststoff sind die Teilchen sehr nah aneinander gepackt, nehmen also weniger Platz ein.