Konduktometrie
Die Konduktometrie ist eine weitere Methode in der Titration den Äquivalenzpunkt zu erkennen. Alles weitere Interessante zu dem Thema findest du im Artikel.
Möchtest du den ganzen Inhalt lieber schnell mit Bild und Ton sehen, dann schau dir doch unser Video an!
Inhaltsübersicht
Konduktometrie einfach erklärt
Mithilfe der Konduktometrie kannst du den Äquivalenzpunkt bei einer Titration oftmals wesentlich exakter bestimmen als durch Verwendung eines Indikators. Bei dieser Methode misst du stetig die Leitfähigkeit deiner Probelösung, während du kontinuierlich die Maßlösung hinzugibst. Da die meisten zu titrierenden Substanzen in der Probelösung als Ion vorliegen, tragen diese auch als bewegliche Ladungsträger zur Leitfähigkeit bei. Neutralisiert man jedoch diese Ionen durch Zugabe der Maßlösung, verringert sich auch die Anzahl an Ladungsträgern und damit auch die Leitfähigkeit. Sind alle Ionen der Probelösung neutralisiert, erreicht die Leitfähigkeit ein Minimum in deiner Messkurve. Dieses Minimum entspricht deinem Äquivalenzpunkt.
Möchtest du noch einmal alles Wichtige zur Titration allgemein wissen, schau unbedingt unseren eigenen Artikel zu diesem Thema an!
Leitfähigkeitsmessung
Da du nun das Grundprinzip verstanden hast, willst du nun bestimmt wissen, wie man das denn in der Praxis umsetzt. Dafür kann man sich folgenden, schematischen Versuchsaufbau anschauen.
Die grundlegenden Bestandteile der anderen Titrationsmethoden findest du auch bei der Konduktometrie. Hier verwendest du auch eine Bürette, mit der du stetig mitverfolgen kannst, wie viel Maßlösung du schon hinzu gegeben hast und ein Gefäß, in der sich ein bekanntes Volumen an Probelösung befindet.
Den Unterschied zu anderen Titrationsarten macht in diesem Fall die Tauchzelle, auch Konduktometer oder Leitfähigkeitsmesszelle genannt. Sie besteht aus zwei parallelen Elektroden. Während der Messung wird an diese ein Wechselstrom angelegt. Dieser kann nun durch die in der Probelösung vorhandenen Ionen weiter geleitet werden. An den beiden Elektroden ist weiterhin auch eine Schaltung angebracht, die den Widerstand bzw. die Leitfähigkeit über die beiden Elektroden misst. Da der Widerstand auch von anderen Parametern abhängt, wie Fläche der Elektroden und Temperatur, muss diese Leitfähigkeitsmesszelle vor ihrem Einsatz geeicht werden. Verändert sich nun die Leitfähigkeit während der Titration, kann man dies also mit dem Konduktometer mitverfolgen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Konduktometrie Ablauf
Wie bereits gesagt, versucht man durch Zugabe von einer Maßlösung die Anzahl an Ionen in der Probelösung zu reduzieren. So kann man bei einer Säure-Base Titration beispielsweise die leitenden Oxonium-Ionen einer sauren HCl Lösung durch Zugabe von Natriumhydroxid-Ionen neutralisieren:

Das dabei entstehende Wasser selbst ist aber ungeladen und kann so nicht mehr zum Ladungstransport beitragen.Falls du noch mehr zum Thema Säure-Base Titration wissen möchtest, dann klicke doch hier .
Natürlich bekommst du für jede Lösung individuelle Leitfähigkeiten, da diese von vorhandenen Ionen abhängen. So bestimmen die folgenden drei Parameter die Leitfähigkeit der Ionen:
- Beweglichkeit der Ionen in der Flüssigkeit
- von Ionen getragene Ladung
- Konzentration der Ionen in der Lösung
Die jeweiligen Leitfähigkeiten der einzelnen Ionen sind praktischer weise schon als Leitfähigkeitsäquivalente tabelliert, so kannst du den Messkurvenverlauf auch von Lösungen mit mehreren Ionenarten analysieren.
Du hast im vorangegangenen Beispiel der Titration von HCl mit NaOH wahrscheinlich schon bemerkt, dass man durch Zugabe von Natriumhydroxid-Ionen zwar die Oxonium-Ionen neutralisiert, jedoch auch neue Ladungsträger in Form von 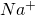 -Ionen hinzufügt. Nun kommt die Beweglichkeit der Ladungsträger ins Spiel. Oxonium- und Hydroxid Ionen können über das Klappen von Wasserstoffbrückenbindungen wesentlich schneller Ladung übertragen als einfache Ionen.
-Ionen hinzufügt. Nun kommt die Beweglichkeit der Ladungsträger ins Spiel. Oxonium- und Hydroxid Ionen können über das Klappen von Wasserstoffbrückenbindungen wesentlich schneller Ladung übertragen als einfache Ionen.
Daher ergibt sich bei einer Säure-Base Titration bei Erreichen des pH-Werts 7 ein Minimum der Leitfähigkeit. Bei weiterer Zugabe der basischen Maßlösung würde sich die Konzentration der Hydroxid-Ionen stark erhöhen, die dann anstatt der Oxonium-Ionen den Ladungstransport in vergleichbarem Maße übernehmen.
Leitfähigkeitstitration Auswertung
Hast du nun den Verlauf der Leitfähigkeit während der Titration stetig mitverfolgt, so trägst du nun die Leitfähigkeit in einem Diagramm gegen das zugegebene Volumen an Maßlösung auf. Dadurch ergibt sich folgender, für die Leitfähigkeitstitration typischer Verlauf:
Man erkennt sehr schnell den charakteristischen Knick in der Kurve. Dieser stellt das Minimum der Leitfähigkeit dar und ist der Punkt, an die komplette Probelösung neutralisiert worden ist. Daher ist dieser Knickpunkt auch der Äquivalenzpunkt. Nun kannst du über diese Stoffmengen-Gleichheit zwischen Maßlösungs-Molekülen und Probelösungs-Molekülen auf die Ausgangskonzentration der Probelösung schließen.
Konduktometrie Varianten
Man kann die Konduktometrie auf mehrere Arten durchführen. Die Vorgehensweise, die du bisher kennengelernt hast, nennt sich Indikationsverfahren. Dabei misst man die Leitfähigkeit der Probelösung mit dem Ziel, am Ende den Äquivalenzpunkt bestimmen zu können.
Neben dieser Vorgehensweise gibt es jedoch auch noch das Bestimmungsverfahren. Bei diesem misst man ebenfalls die Leitfähigkeit, jedoch rechnet man am Ende nicht den Äquivalenzpunkt aus, sondern bedient sich einiger Kalibrationskurven.
Konduktometrie im Vergleich zu anderen Titrationsverfahren
Zum Abschluss stellst du dir vielleicht noch die Frage, welchen Vorteil die Konduktometrie gegenüber den anderen Verfahren bietet. Um das zu beantworten, musst du die typische Titrationskurve der Konduktometrie einmal der klassischen Titrationskurve gegenüberstellen.
Wenn du bei einer klassischen Titrationskurve das Tangentenverfahren wählst, um deinen Äquivalenzpunkt zu bestimmten, können schon kleine Abweichungen in der Wahl des Tangentenpunkts zu großen Fehlern im Äquivalenzpunkt führen. Dieses grafische Bestimmungsverfahren brauchst du bei der Konduktometrie eben nicht. Hier ist der Äquivalenzpunkt durch den charakteristischen Knick in der Kurve schon gegeben. Es können bei der Bestimmung aus dem Graphen also kaum Fehler unterlaufen.



