Rutherford Streuversuch
Möchtest du mehr über den Aufbau und die Bedeutung vom Rutherford Streuversuch erfahren? Dann schau dir dazu unser Video und diesen Artikel an!
Inhaltsübersicht
Rutherford Streuversuch einfach erklärt
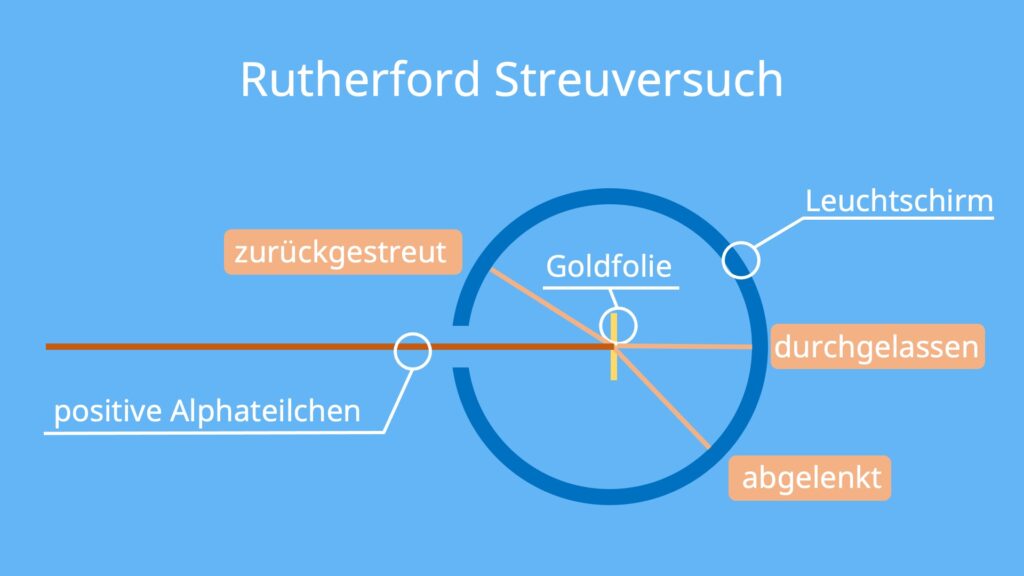
Beim Rutherford Streuversuch werden Alphateilchen auf eine Goldfolie gestrahlt. Die Alphateilchen sind positiv geladene Heliumkerne. Sie haben keine Elektronen. Ziel des Versuchs ist es zu sehen, ob und wie die Alphateilchen abgelenkt werden. Um die Bewegung der Teilchen nach dem Auftreffen auf die Goldfolie zu sehen, gibt es einen Leuchtschirm um die Folie herum.
Nach der damaligen Vorstellung vom Atomaufbau, war die Erwartung des Versuchs, dass die Teilchen einfach durch die Folie durchgelassen werden. Es wurden aber Teilchen abgelenkt und sogar zurückgestreut.
Deshalb hat Ernest Rutherford ein neues Atommodell eingeführt. Dabei ist der größte Unterschied beim Rutherford Atommodell , dass es im Inneren des Atoms einen sehr kleinen, positiv geladenen Atomkern beinhaltet.
Rutherford Streuversuch Aufbau
Der Aufbau des Rutherford Streuversuch besteht im wesentlich aus einem Strahl aus Alphateilchen, einer Goldfolie und einem Leuchtschirm.
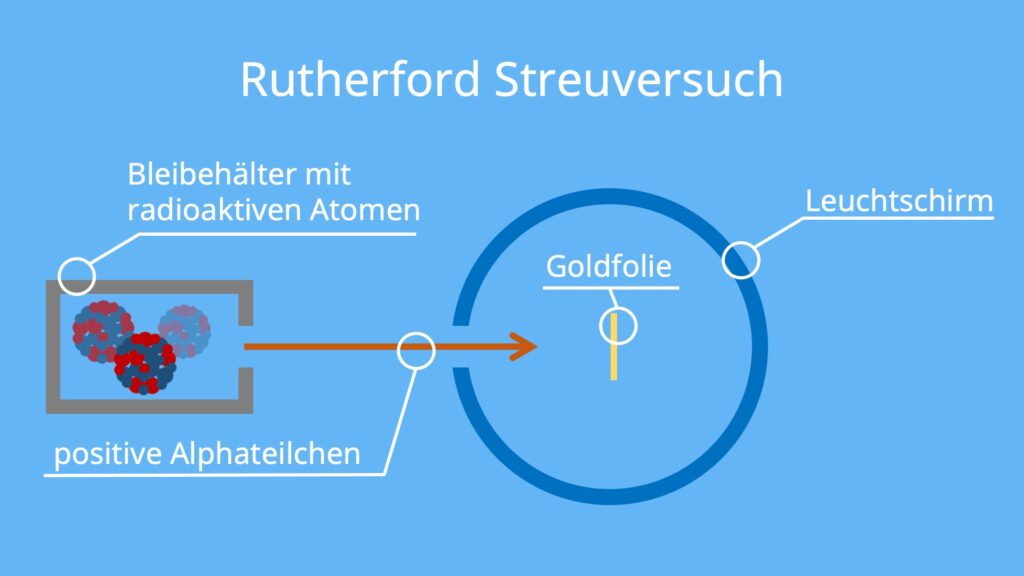
Die Quelle der Alphastrahlung ist Radium. Radium ist radioaktiv und setzt deswegen durch radioaktiven Zerfall positiv geladene Alphateilchen frei. Alphateilchen sind zweifach positive Heliumkerne mit keinem Elektron.
Aus einer Öffnung in einem Bleibehälter strahlen die Alphateilchen auf eine dünne Goldfolie. Dort können die Teilchen entweder abgelenkt werden oder dringen durch die Goldfolie durch. Um zu erkennen, wie sich die Teilchen verhalten, ist ein kreisförmiger Leuchtschirm um die Folie platziert. Treffen die Teilchen auf den Schirm, leuchten sie nämlich mit einem kleinen Lichtblitz auf.
Streuversuch Erwartungen
Aufgrund des damaligen Thomsonschen Atommodells hatte Rutherford die Erwartung, dass die meisten Alphateilchen in einer geraden Linie durch die Goldfolie durchdringen.
Beim Modell von Thomson ging man nämlich davon aus, dass das Atom elektrisch neutral ist und seine positive Ladung wie auch die Masse gleichmäßig auf das Atom verteilt ist. Die Elektronen liegen an festen Plätzen innerhalb des Atoms. Das kannst du dir wie Rosinen im Kuchen vorstellen (Rosinenkuchenmodell).
Wenn die gesamte Masse des Atoms also gleichmäßig verteilt ist, sollten die Alphateilchen dank ihrer Größe und Energie ungehindert durch das Atom dringen. Wegen der gleichmäßigen Verteilung der Ladungen ist das Atom insgesamt neutral, weshalb die Alphateilchen auch durch die Ladung nicht abgelenkt werden sollten.
Streuversuch Beobachtungen
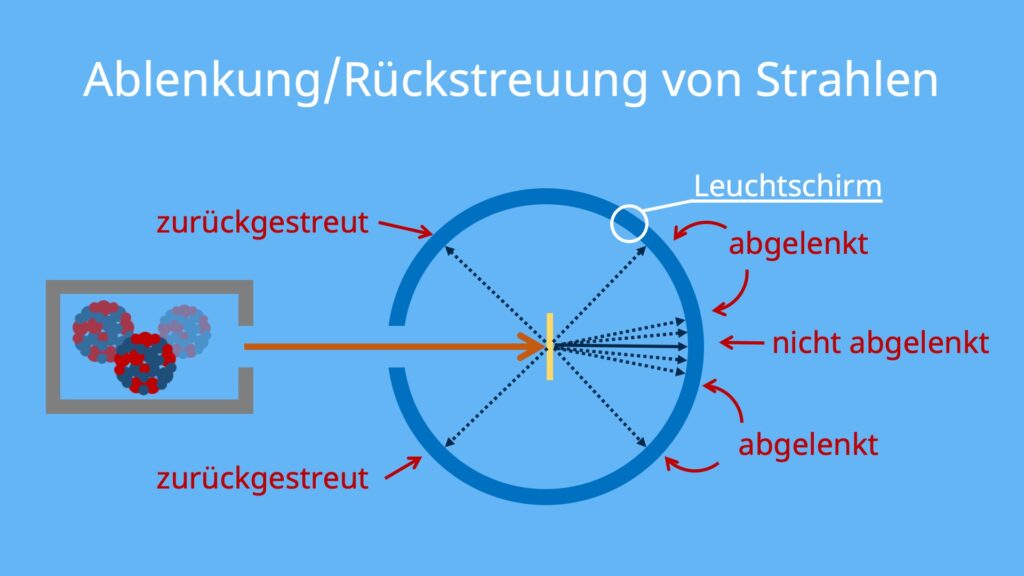
Anders als erwartet sind nicht alle Alphateilchen ungehindert durch die Goldfolie gedrungen. Die meisten Teilchen konnten in gerader Linie hinter der Goldfolie auf dem Schirm beobachtet werden. Einige Teilchen wurden aber auch etwas nach links und rechts abgelenkt. Entgegen der Erwartungen wurden sehr wenige Teilchen sogar zurückgestreut!
Beim Rutherford Streuversuch konnte auch beobachtet werden, dass die Ablenkung mit hohen Ablenkwinkeln deutlich seltener war. Daher wurden auch nur wenige Alphateilchen genau entgegen der Einstrahlrichtung zurückgestreut.
Streuversuch Schlussfolgerungen
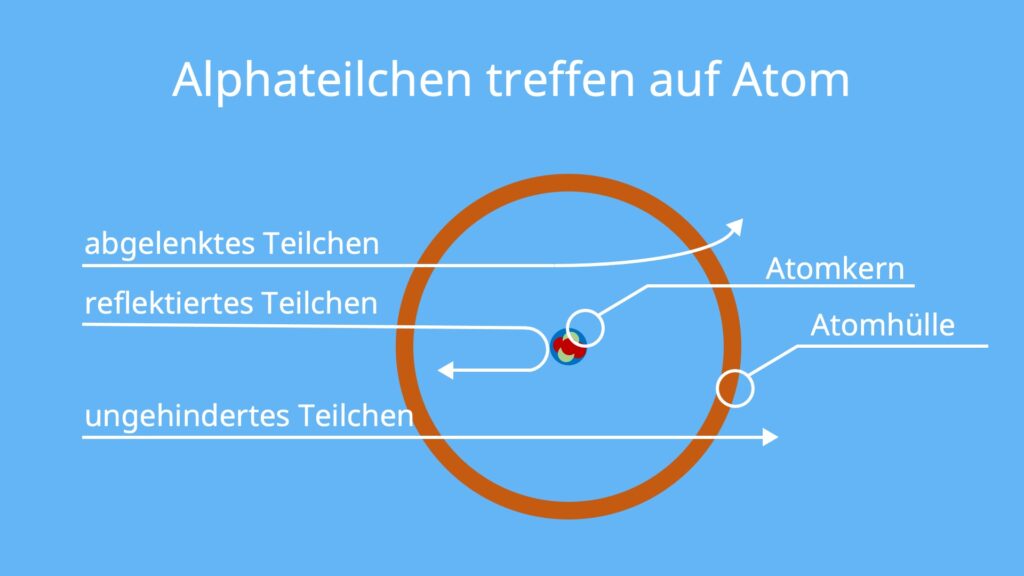
Die Beobachtungen des Rutherfordschen Streuversuchs stimmten nicht mit den Erwartungen überein. Weil die Teilchen sehr selten zurückgestreut wurden, muss der größte Teil der Masse in einem sehr kleinen Punkt gesammelt sein, zum Beispiel in einem Atomkern. Die Chance, dass ein Teilchen direkt auf den Kern trifft, ist also eher gering.
Wenn die gesamte Masse im Atomkern ist, wäre dort auch die gesamte positive Ladung. Dementsprechend erklärt Rutherford die Ablenkung der positiven Teilchen damit, dass sie sehr nah am Atomkern vorbeigeflogen sind und durch die positive Ladung abgestoßen, also abgelenkt wurden.
Der Rest des Atoms ist laut Rutherford dann mit den Elektronen gefüllt und ansonsten „leer“. Der Atomkern ist also nur von der Hülle des Atoms und den Elektronen umgeben. Durch diese „Leere“ in der Elektronenhülle und weil die Elektronen so viel kleiner als Alphateilchen sind, konnte der Großteil der Teilchen ohne jegliche Ablenkung hinter der Goldfolie ankommen.
All diese Erkenntnisse widersprachen dem Thomsonschen Modell, weshalb Rutherford ein eigenes Atommodell entwarf. Das Rutherford Atommodell.
Rutherford Atommodell
Beim Rutherford Atommodell sind alle Schlussfolgerungen aus dem Rutherfordscher Streuversuch mit eingeflossen. Demnach hat ein Atom laut Rutherford:
- einen sehr kleinen, positiv geladenen Atomkern, der fast die gesamte Masse des Atoms enthält
- eine fast 3000-mal größere Atomhülle, welche zum größten Teil „leer“ ist und aus „Nichts“ besteht
- Elektronen, die um den Atomkern kreisen und die positive Ladung vom Atomkern nach außen abschirmen
Dadurch ist das Atommodell Rutherfords viel näher am heutigen Verständnis des Atoms als Thomsons Modell.
Probleme des Rutherford Atommodells
Obwohl du mit dem Rutherfordschen Atommodell vieles zum Atomaufbau erklären kannst, stößt es schnell an seine Grenzen. So umfasst es zum Beispiel nicht die unterschiedlichen Energieniveaus der Elektronen. Doch sind sie nötig, um die Spektrallinien verschiedener Gase zu erklären.
Zudem ist es auch nicht möglich, mit dem Rutherfordschen Atommodell zu begründen, warum die Elektronen nicht in den Kern stürzen, wenn sie um den Atomkern kreisen. Elektronen auf einer Kreisbahn sind beschleunigte Ladungen und geben deshalb Energie in Form von Strahlung ab. Laut dem Atommodell Rutherfords ist von Strahlung aber keine Rede. Demnach würden die Elektronen nicht in einer stabilen Kreisbahn um den Atomkern kreisen. Stattdessen würden sie nach und nach in den Atomkern stürzen.
Atommodelle
Durch die vielen Probleme des Rutherfordschen Atommodells wurde es später durch das Bohrsche Atommodell und anschließend das Schalenmodell abgelöst. Willst du noch mehr über die vielen verschiedenen Atommodelle erfahren? Welche es gibt, erklären wir dir in einem Video ! Schau doch gleich rein!