Pufferlösung
Was ist eine Pufferlösung und wie funktioniert sie? Das und vieles mehr beantworten wir dir in unserem Beitrag!
Inhaltsübersicht
Was ist ein Puffer?
Eine Pufferlösung, Puffersystem oder auch Puffer, ist ein Stoffgemisch aus einer schwachen Säure und ihrer korrespondierenden Base. Puffer zeichnen sich dadurch aus, dass der pH-Wert bei Zugabe einer Säure oder einer Base gleich bleibt.
Weil Pufferlösungen ihren pH-Wert stabil halten können, finden sie häufig Anwendung in der Biochemie. Hier helfen sie dabei, dass Reaktionen unter einem konstanten pH-Wert ablaufen.
In unseren Zellen und in unserem Blut sind Puffersysteme ebenfalls von großer Bedeutung. Alle wichtigen Informationen aus dem Beitrag findest du auch in unserem Video !
Wirkungsweise von Puffersystemen
Die Aufgabe einer Pufferlösung ist es, den pH-Wert relativ konstant zu halten. Schauen wir uns die Wirkungsweise mal anhand eines Essig-Acetat-Puffers an. Er besteht aus einer wässrigen Lösung mit einem Verhältnis 1:1 von Essigsäure (CH3COOH) und der konjugierten Base Acetat (CH3COO−). Die Reaktion befindet sich dabei im Gleichgewicht:
CH3COOH + H2O ⇌ CH3COO− + H3O+
Reaktion bei Zugabe einer Säure
Gibst du nun eine Säure in das Puffersystem, dann befinden sich mehr Oxonium-Ionen (H3O+) in der Lösung. Durch die erhöhte Konzentration der H3O+-Ionen der rechten Seite, läuft jetzt die Rückreaktion zu Essigsäure und Wasser verstärkt ab (Prinzip-vom-kleinsten-Zwang
). Die zusätzlichen Oxonium-Ionen werden durch die verstärkte Rückreaktion abgebaut. Der pH-Wert pendelt sich wieder ein.
CH3COOH + H2O 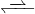 CH3COO− + ↑ H3O+
CH3COO− + ↑ H3O+
Reaktion bei Zugabe einer Base
Bei Zugabe einer Base in die Pufferlösung findet die umgekehrte Reaktion statt. Durch die Base erhöht sich die Konzentration der Hydroxid-Ionen (OH–). Dadurch reagiert die Essigsäure verstärkt und baut die Hydroxid-Ionen ab. Die Hydroxid-Ionen reagieren daher nicht mit den H3O+-Ionen. Der pH-Wert bleibt quasi gleich.
CH3COOH + ↑ OH–  CH3COO− + H2O
CH3COO− + H2O
Hinweis: Der pH-Wert gibt an, wie sauer oder basisch eine wässrige Lösung ist. Je niedriger der pH-Wert ist, desto mehr Wasserstoffionen befinden sich in der Lösung und desto sauerer ist das Gemisch.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Das Optimum der Pufferlösung
Das Optimum der Pufferlösung ist der pH-Bereich, in dem sich bei Zugabe einer Säure (Oxonium-Ionen) oder einer Base (Hydroxid-Ionen) der pH-Wert der Pufferlösung am wenigsten ändert. Der pH-Bereich des Optimums entspricht dabei dem pKs-Wert der Puffersäure.
Hinweis: Der pKs-Wert gibt an, wie stark oder schwach eine Säure in einer wässrigen Lösung ist. Je kleiner der pKs-Wert, desto stärker ist die Säure. Sie gibt somit leichter ihre Protonen ab. Dadurch entstehen mehr Oxonium-Ionen (H3O+) in der Lösung.
Innerhalb des pH-Bereiches liegen die Puffersäure und die Pufferbase im Verhältnis 1:1 vor. Dadurch können sowohl zugefügte Oxonium-Ionen als auch Hydroxid-Ionen gut abgepuffert werden.
Ist der pH-Wert der Pufferlösung kleiner als der pKs-Wert der Säure, dann liegt mehr Puffersäure in der Lösung vor. Dadurch können Hydroxid-Ionen zwar besser abgefangen werden, die Oxonium-Ionen jedoch nicht. So wird das Puffersystem saurer.
Bei einem höheren pH-Wert als der pKs-Wert ist mehr Pufferbase in der Lösung enthalten. Die Folge ist, dass Hydroxid-Ionen schlechter abgefangen werden und das Puffersystem alkalisch wird.
Merke: In der Regel unterscheidet sich der pH-Wert der Pufferlösung nicht mehr als ± 1-Einheiten vom pKs-Wert der Puffersäure.
Arten von Pufferlösungen
Hier geben wir dir einen Überblick über einige typische Pufferlösungen und ihren pH-Bereich.
| Puffer | pH-Bereich |
| Essigsäure-Acetat-Puffer | 3,7 bis 5,7 |
| Phosphatpuffer | 5,4 bis 8,0 |
| Ammoniakpuffer | 8,2 bis 10,2 |
| Kohlensäure-Bicarbonat-Puffer | 6,2 bis 8,6 |
| Kohlensäure-Silikat-Puffer | 5,0 bis 6,2 |
| Veronal-Acetat-Puffer nach Michaelis | 2,6 bis 9,2 |
Eine Pufferlösung ist sehr leicht herzustellen. Dafür mischst du einfach:
- eine schwache Säure mit ihrem Salz bzw. ihrer konjugierten Base
- eine schwache Base mit ihrem Salz bzw. ihrer konjugierten Säure
pH-Wert Puffer berechnen
Für die Berechnung des pH-Wertes eines Puffersystems gehst du von der allgemeinen Reaktionsgleichung einer Säure-Base-Reaktion aus:
HA + H2O ⇌ A– + H3O+
Hierbei steht HA für die Puffersäure und A– für die Base. Den pH-Wert des Puffers kannst du nun ganz leicht mit der Henderson-Hasselbalch-Gleichung (Puffergleichung) berechnen:

- c (A–) = Konzentration der Pufferbase in (mol/l)
- c(HA)= Konzentration der Puffersäure in (mol/l)
- pKs = pKs-Wert der Puffersäure
Wenn du wissen willst, wie die Henderson-Hasselbalch-Gleichung hergeleitet wird oder die Rechnung an einem Beispiel sehen möchtest, dann schau dir jetzt unser Video dazu an!
Pufferlösung — häufigste Fragen
(ausklappen)
Pufferlösung — häufigste Fragen
(ausklappen)-
Was genau ist eine Pufferlösung?Eine Pufferlösung ist ein Gemisch aus einer schwachen Säure und ihrer korrespondierenden Base. Dadurch kann sie den pH-Wert bei Zugabe von Säuren oder Basen weitgehend stabil halten. Solche Puffer werden zum Beispiel genutzt, damit Reaktionen in der Biochemie bei konstantem pH ablaufen.
-
Warum bleibt der pH-Wert in einer Pufferlösung fast gleich?Der pH-Wert bleibt fast gleich, weil zugegebene Oxonium- oder Hydroxid-Ionen im Puffersystem umgesetzt werden. Die Pufferbase nimmt Protonen auf und fängt so Oxonium-Ionen ab, während die Puffersäure Protonen abgeben kann und dadurch Hydroxid-Ionen neutralisiert.
-
Was passiert im Essigsäure-Acetat-Puffer wenn ich eine Säure dazugebe?Gibst du Säure dazu, werden die zusätzlichen Oxonium-Ionen im Essigsäure-Acetat-Puffer durch die Rückreaktion abgebaut. Weil mehr H3O+ vorhanden ist, verschiebt sich das Gleichgewicht zu Essigsäure und Wasser (Prinzip vom kleinsten Zwang). Dadurch pendelt sich der pH-Wert wieder ein.
-
Was ist das Optimum einer Pufferlösung?Das Optimum einer Pufferlösung ist der pH-Bereich, in dem sich der pH bei Zugabe von Säure oder Base am wenigsten ändert. Dieser Bereich entspricht dem pKs-Wert der Puffersäure, weil dann Puffersäure und Pufferbase im Verhältnis 1:1 vorliegen und beides gut abgefangen wird.
-
Wie berechne ich den pH-Wert von einem Puffersystem?Den pH-Wert eines Puffersystems berechnest du mit der Henderson-Hasselbalch-Gleichung:
 . Dabei ist
. Dabei ist  die Konzentration der Pufferbase,
die Konzentration der Pufferbase,  die Konzentration der Puffersäure und pKs der pKs-Wert der Säure.
die Konzentration der Puffersäure und pKs der pKs-Wert der Säure.
pKs-Wert
Das pH-Optimum eines Puffersystems entspricht dem pKs-Wert der Puffersäure. Was der pKs-Wert dir sonst noch alles verrät und wie du ihn bestimmen kannst, erfährst du in unserem kurzen Video dazu!

