Galvanische Zelle
Was ist eine galvanische Zelle und was ist das Daniell-Element? Alles zum Aufbau und der Funktionsweise einer galvanischen Zelle erklären wir dir mit vielen Beispielen hier im Beitrag oder direkt im Video !
Inhaltsübersicht
Galvanische Zelle einfach erklärt
Eine galvanische Zelle (auch galvanische Kette oder galvanisches Element) ist ein Aufbau, bei dem chemische in elektrische Energie umgewandelt wird. Eine galvanische Zelle besteht dabei aus zwei verschiedenen Elektroden (Anode, Kathode) und einer leitfähigen Flüssigkeit, dem Elektrolyten.
Besonders bekannt ist das sogenannte Daniell-Element, das aus einer Zink- und einer Kupferelektrode besteht.
Im galvanischen Element findet eine Redoxreaktion statt, die freiwillig abläuft. Es werden also Elektronen übertragen. Dabei sind die Orte der Teilreaktionen, also der Reduktion und der Oxidation, voneinander getrennt. Damit Strom fließen kann, sind beide Orte elektrisch leitend über einen Draht miteinander verbunden.
Dein Handy-Akku oder auch eine Batterie sind Beispiele für galvanische Zellen.
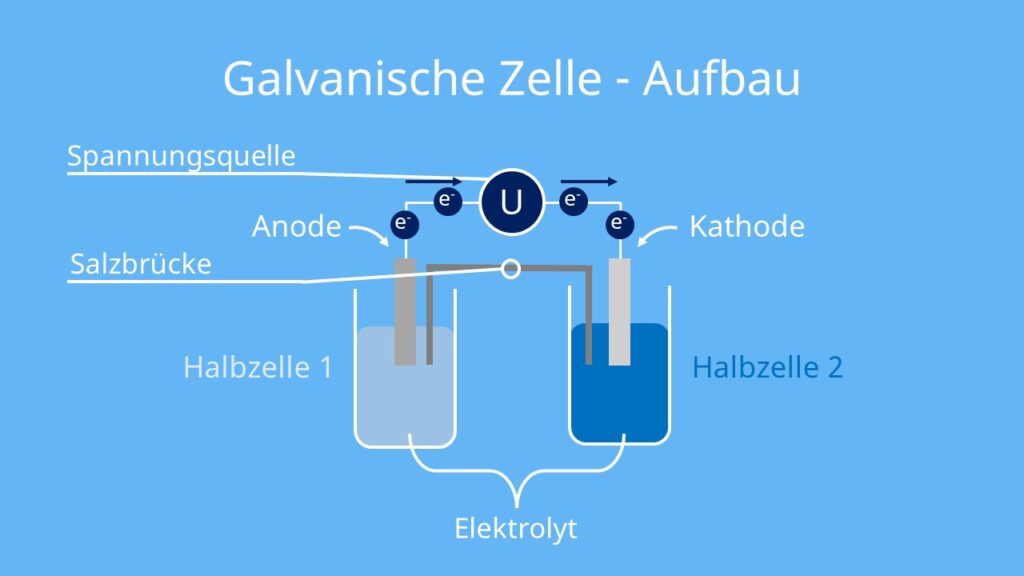
Galvanische Zelle Aufbau
Der allgemeine Aufbau einer galvanischen Zelle sieht folgendermaßen aus.
Ein galvanisches Element hat zwei verschiedene Elektroden:
- negativ geladene Anode: Minuspol (-)
- positiv geladene Kathode: Pluspol (+)
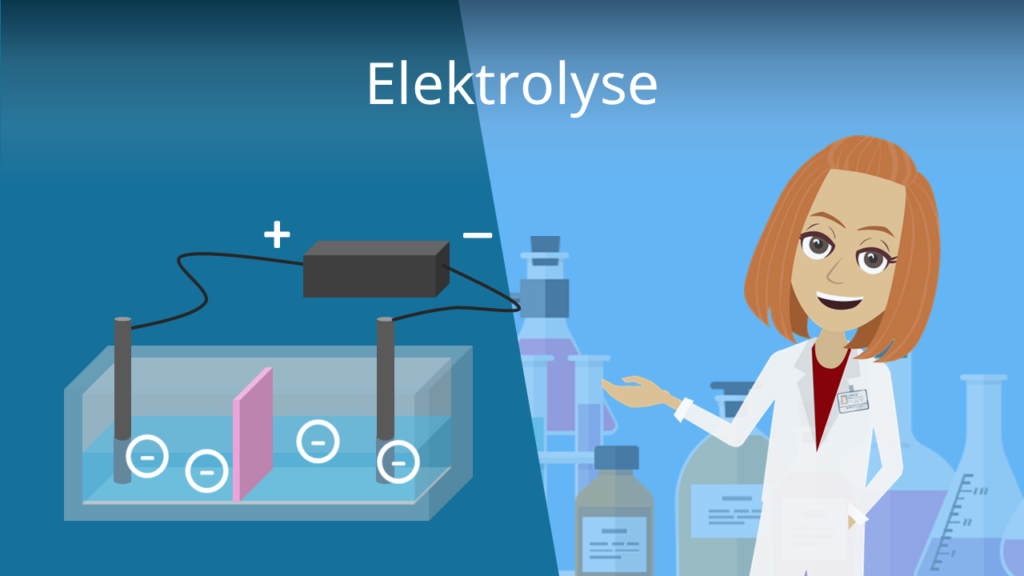
Aufgepasst: Bei einer Elektrolyse ist die Anode der Pluspol und die Kathode der Minuspol! Dabei handelt es sich sozusagen um die Umkehrreaktion der galvanischen Zelle, bei der aus elektrischer Energie chemische Energie gewonnen wird.
Beide Elektroden einer galvanischen Zelle befinden sich in einer (oder zwei verschiedenen) Elektrolytlösung(en). Bei Metallen ist das in der Regel die dazugehörige Metallionenlösung. Bei Kupfer (Cu) also beispielsweise eine Lösung aus Kupferionen (Cu2+). Die Kombination aus Elektrode und Elektrolytlösung nennst du Halbzelle oder Halbelement.
Aufbau der Halbzellen
Eine galvanische Zelle besteht also aus zwei Halbzellen, die räumlich getrennt sind. Somit laufen auch die Teilreaktionen der Redoxreaktion — Reduktion und Oxidation — getrennt in je einer Halbzelle ab. Hier gilt:
- Beide Halbzellen sind elektrisch leitend über einen Draht miteinander verbunden.
- Beide Halbzellen sind zudem über eine Ionenbrücke (Salzbrücke) oder eine halbdurchlässige Trennwand (Diaphragma) verbunden. Das ist wichtig, damit Ionen von einer Zelle zur anderen ‚wandern‘ können, um einen Ladungsausgleich zu ermöglichen.
Kurzschreibweise
Du schreibst eine galvanische Zelle oft auch in der Kurzschreibweise. Hierfür trennst du die beiden Halbzellen mit einem Doppelstrich ( | | ). Er soll die poröse Trennwand, das Diaphragma, darstellen. Meist steht die Anode zudem links, die Kathode rechts.
Am Beispiel einer Zink- und Kupferhalbzelle, also dem Daniell-Element, schreibst du:
Zn | Zn2+ | | Cu2+ | Cu
Galvanische Zelle Funktionsweise
In einer galvanischen Zelle findet eine Redoxreaktion statt, es werden also Elektronen übertragen.
Damit du weißt, in welcher Halbzelle eine Reduktion (Elektronenaufnahme) und in welcher eine Oxidation (Elektronenabgabe) stattfindet, schaust du dir am besten die Redoxreihe an. Dort sind die Elemente nach ihrem sogenannten Redoxpotential bei Standardbedingungen geordnet. Du nennst es auch Standardelektrodenpotential. Darunter verstehst du das Maß für die Bereitschaft eines Elements Elektronen aufzunehmen. Hier gilt:
- Je negativer das Redoxpotential ist, desto bereitwilliger gibt das Element Elektronen ab. Die Reduktionskraft einer solchen Elektrode ist also hoch.
- Umgekehrt gilt entsprechend: Je positiver das Potential, desto ‚lieber‘ nimmt das Element Elektronen auf.
- Eine Elektrode mit einem negativen Standardpotential bezeichnest du als unedel. Beispiele sind Eisen (-0,41 V) oder Zink (-0,76 V). Sie geben ihre Elektronen ‚gerne‘ ab.
- Hat eine Elektrode hingegen ein positives Standardpotential haben, nennst du sie edel. Beispiele hierfür sind Kupfer (+0,35 V) oder Silber (+0,80 V). Sie geben ihre Elektronen nicht so bereitwillig ab.
Die Elektronen fließen immer von dem Redoxpaar mit dem negativeren Potential zu dem Redoxpaar mit dem positiveren Potential. Oder anders formuliert: Die Elektronen fließen von der Anode zur Kathode.
Als Redoxpaar bezeichnest du die reduzierte und oxidierte Form eines Stoffes. Ein Beispiel dafür ist das Redoxpaar von Kupfer Cu | Cu2+ oder von Zink Zn | Zn2+. Beide kommen im Daniell-Element vor.
Galvanische Zelle Spannung
Werden beide Halbzellen mit einem Draht und einem Ionenleiter verbunden, kannst du die Spannung des elektrischen Stroms messen. Je nachdem, welche Elemente du kombinierst bzw. welche Konzentrationen die Elektrolytlösungen haben, unterscheidet sich die Spannung.
Wenn du bestimmen willst, welche Spannung zwischen den beiden Halbelementen der galvanischen Zelle herrscht, hilft dir die sogenannte Nernst Gleichung weiter. Schau unbedingt bei unserem Video dazu vorbei und finde heraus, wie du sie korrekt anwendest!
Eselsbrücken
Anode: Elektrode, an der die Oxidation stattfindet.
- An-o-de: An Oxidation denken
- Anode und Oxidation sind das A und O der Elektrochemie
- O-M-A (Oxidation, Minuspol, Anode)
Kathode: Elektrode, an der die Reduktion stattfindet
Tipp: Wenn du die Eselsbrücken der Anode beherrscht, dann denke daran, dass es sich bei der Kathode, um das Gegenteil handelt: also Pluspol und Reduktion.
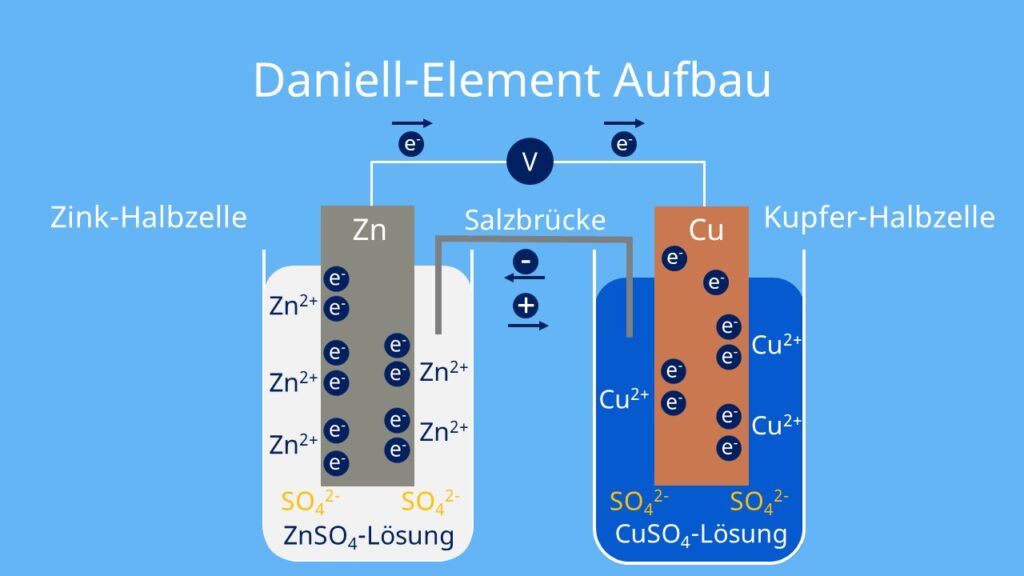
Daniell-Element
Ein sehr bekanntes Beispiel für die galvanische Zelle ist das Daniell-Element oder auch Daniell’sches Element. Es besteht aus einer Kupfer- und einer Zinkhalbzelle.
Daniell-Element Aufbau
Das Daniell-Element ist folgendermaßen aufgebaut:
- Kupferhalbzelle: besteht aus einem Kupferstab in einer Kupfersulfatlösung (CuSO4)
- Zinkhalbzelle: besteht aus einem Zinkstab in einer Lösung aus Zinksulfat (ZnSO4)
- Beide Halbzellen werden über einen Draht elektrisch leitend miteinander verbunden.
- Außerdem sind beiden Halbzellen über eine Salzbrücke oder ein Diaphragma (halbdurchlässige Trennschicht) verbunden.
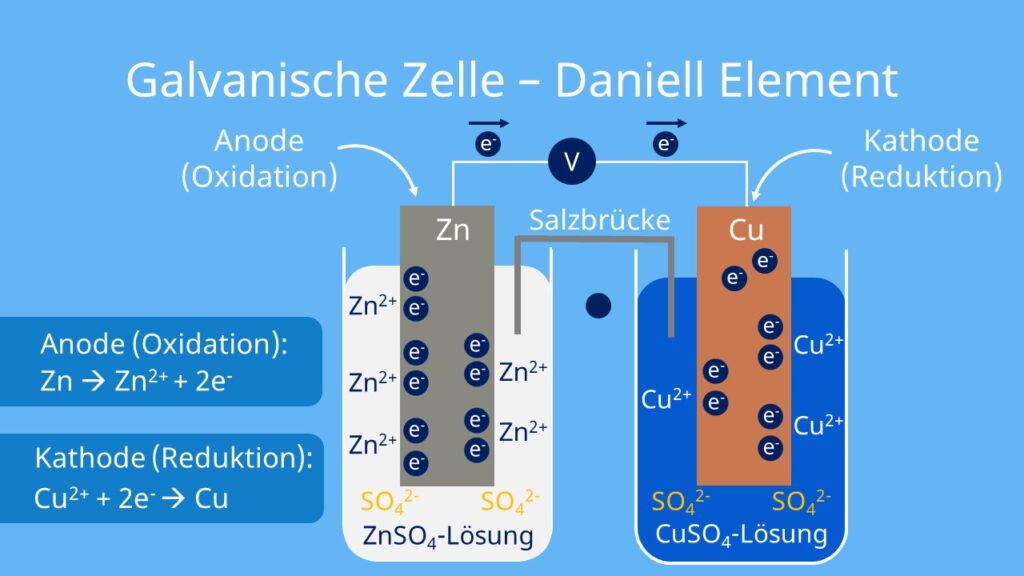
Daniell-Element Funktionsweise
So funktioniert das Daniell-Element:
- Kupfer ist edler als Zink: Es hat mit +0,34V ein positiveres Redoxpotential als Zink mit -0,76 V.
- Das Bestreben von Zink Elektronen abzugeben ist daher groß. Dadurch gehen an der Zinkelektrode verhältnismäßig viele positiv geladene Zinkionen (Zn2+) in Lösung.
- Kupfer gibt nicht so ‚gerne‘ Elektronen ab. An der Kupferkathode lösen sich somit nur wenige Ionen (Cu2+) ab.
- Da in der Zinkelektrode mehr Elektronen im Metall ‚zurückgelassen ‚werden, ist sie negativer geladen als die Kupferelektrode. Dadurch bildet sich eine elektrische Spannung.
- Die Elektronen ‚wandern‘ immer vom negativeren zum positiveren Redoxpotential. Daher fließen die überschüssigen Elektronen über einen Leiter von der Zinkelektrode zur Kupferelektrode. Dabei kannst du eine Spannung von 1,1 Volt messen.
- Die Kupferionen in der Lösung nehmen nun die Elektronen auf und elementares Kupfer lagert sich an der Elektrode an.
- Nach einiger Zeit sind sehr viele Zinkionen in Lösung und die Zinkhalbzelle lädt sich positiv auf. Bei der Kupferhalbzelle passiert genau das Gegenteil. Damit ein Ladungsausgleich stattfinden kann, gibt es eine Ionenbrücke oder ein Diaphragma.
Bei einem Daniell-Element laufen also folgende Reaktionen ab:
Anode (Oxidation): Zn → Zn2+ + 2 e–
Kathode (Reduktion): Cu2++ 2e– → Cu
Gesamtreaktion (Redoxreaktion): Zn + Cu2+ → Zn2+ + Cu
Galvanische Zelle Einteilung
Grundsätzlich kannst du galvanische Zellen in drei Gruppen einteilen:
- Primärzellen: Primärzellen sind galvanische Elemente, die nach der Entladung nicht wieder neu aufgeladen werden können. Die Entladung ist also unumkehrbar. Du bezeichnest Primärzellen auch umgangssprachlich als Batterien.
- Sekundärzellen: Die Besonderheit an Sekundärzellen ist, dass sie nach einer Entladung wieder aufgeladen werden können. Voraussetzung dafür ist aber, dass die Stromrichtung der Aufladung gegenläufig zu der Stromrichtung der Entladung ist. Die Zellen kennst du bestimmt unter dem Namen Akku oder Akkumulator.
- Tertiärzellen: Bei den Tertiärzellen wird der chemische Energieträger nicht in der Zelle gespeichert, sondern wird von außen durchgehend zur Verfügung gestellt. Im Prinzip kannst du dadurch einen zeitlich unbeschränkten Betrieb gewährleisten. Du nennst die Zellen auch Brennstoffzelle.
Galvanische Zelle Beispiele
Je nachdem, welche Halbzellen du miteinander kombinierst, bilden sich die unterschiedlichsten Arten von galvanischen Elementen.
Hier erklären wir dir den Aufbau und die Funktion wichtiger Beispiele für eine galvanische Zelle:
- Lechlanché Element (Primärzelle)
- Lithium-Ionen-Akku (Sekundärzelle)
- Wasserstoff-Brennstoffzelle (Tertiärzelle)
Leclanché Element
Das Leclanché Element (auch Zink-Braunsteinzelle) ist eine Primärzelle, also eine Batterie. Es ist folgendermaßen aufgebaut:
- Anode: Zinkanode (Zn)
- Kathode: gepressten Mischung aus Braunstein (MnO2) und Kohlenstoff
- Elektrolyt: Ammoniumchloridlösung (NH4Cl)
Bei der Stromabgabe laufen vereinfacht folgende Reaktionen ab:
Anode (Oxidation): Zn → Zn2+ + 2 e–
Kathode (Reduktion): 2MnO2 + 2H+ + 2e– → 2MnO(OH)
Elektrolytlösung (Komplexbildung): Zn2+ + 2NH4+ + 2Cl– → [Zn(NH3 )2]Cl2 + 2H+
Gesamtreaktion (Redoxreaktion): Zn + 2MnO2 + 2NH4+ + 2Cl– → [Zn(NH3 )2]Cl2+ 2MnO(OH)
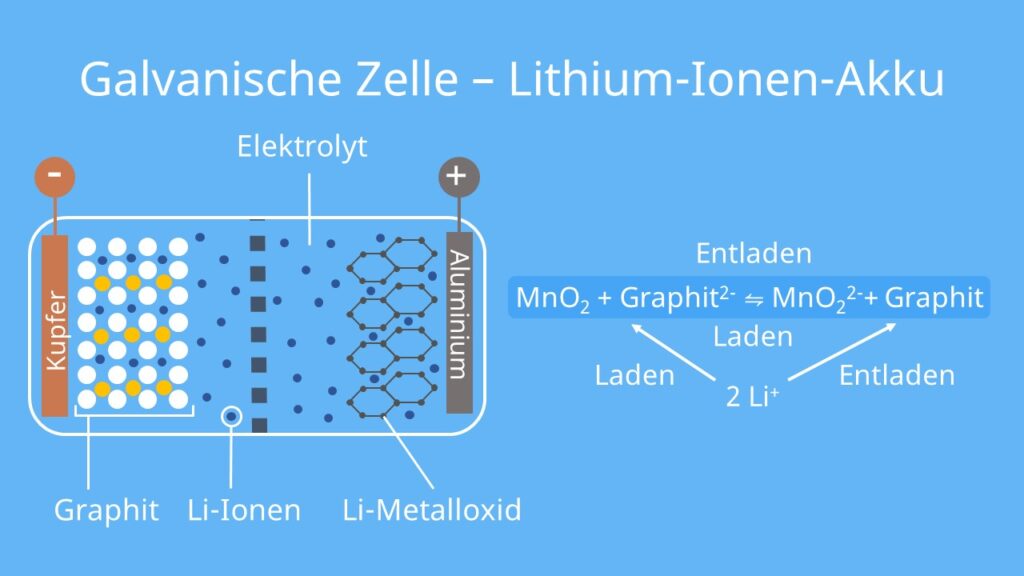
Lithium-Ionen-Akku
Der Lithium-Ionen-Akku oder Lithium-Ionen-Akkumulator ist eine Sekundärzelle. Er besteht auf der einen Seite aus einer Aluminiumschicht und einer Kupferschicht auf der anderen Seite. Sie sorgen für eine geeignete Leitfähigkeit.
Der Aufbau des Akkus sieht so aus:
- Anode: besteht aus einer Graphitelektrode
- Kathode: Mischung von Metallsalzen wie z. B. Lithium-, Cobalt-, Mangan- oder Nickeloxiden (Li2MnO2)
- Elektrolyt: meist organisches Lösungsmittel mit einem Lithiumsalz
Der Lithium-Ionen-Akku funktioniert so:
- Die Lithiumionen (Li+) wandern beim Laden und Entladen zwischen den Elektroden hin und her.
- Beim Laden des Akkus nimmt das Graphitgitter die Lithiumionen auf.
- Beim Entladen werden Lithiumionen von den Metalloxiden eingelagert.
Die Reaktionen beim Laden und Entladen sehen wie folgt aus:
Laden:
Anode (Oxidation): Li2MnO2 → MnO2 + 2 Li+ + 2e–
Kathode (Reduktion): Graphit + 2e– + 2 Li+ → Li2Graphit
Entladen:
Anode (Oxidation): Li2Graphit → Graphit + 2e– + 2 Li+
Kathode (Reduktion): MnO2 + 2 Li+ + 2e– → Li2MnO2
Merke: Die Anode ist beim Laden mit dem Pluspol verbunden und die Kathode mit dem Minuspol. Beim Entladen sind Kathode und Anode genau entgegengesetzt verbunden.
Brennstoffzelle
Die Brennstoffzelle ist eine Tertiärzelle. Sie wandelt die chemische Reaktionsenergie eines durchgehend zugeführten Brennstoffes und eines Oxidationsmittels in elektrische Energie um.
Die Funktionsweise der Brennstoffzelle ist ähnlich zu der Funktionsweise einer Batterie. Ein Beispiel ist die Wasserstoff-Brennstoffzelle. Hier sind die chemischen Reaktionspartner die Gase Wasserstoff (H2) und Sauerstoff(O2).
Das Prinzip der Brennstoffzelle kannst du mit folgender Reaktionsgleichung beschreiben:
2 H2 + O2 → 2 H2O
Elektrolyse
Bei einer Galvanischen Zelle läuft die Redoxreaktion freiwillig ab. Das ist bei einer Elektrolyse nicht der Fall. Es handelt sich dabei nämlich um eine gezwungene Redoxreaktion. Wie eine Elektrolyse genau funktioniert, erklären wir dir hier im extra Video !