Redoxreaktionen II
Hier zeigen wir dir ein genaues Vorgehen für das Aufstellen einer Redoxgleichung. Schau dir auch unser Video dazu an!
Inhaltsübersicht
Redoxreaktion Beispiel
In unserem ersten Beitrag zu Redoxreaktionen erklären wir dir die Grundlagen. Außerdem haben wir dir das Vorgehen vorgestellt, dass du zum Aufstellen der Reaktionsgleichungen brauchst.
Das sind folgende Schritte:
- Bestimmen der Oxidationszahlen
- Bestimmen der Teilreaktionen (Oxidation, Reduktion)
- Einzeichnen der übertragenen Elektronen
- Ladungsausgleich
- Stoffausgleich
- Ausgleich der Elektronen
- Addition der Teilgleichungen und Kürzen der Gesamtgleichung
Wir schauen uns nun folgende Beispielaufgabe genauer an:
Kupferoxid reagiert mit Kohlenstoff zu elementarem Kupfer und Kohlenstoffdioxid.
Die Summengleichung siehst du hier:
CuO + C → Cu + CO2
Schritt 1: Bestimmen der Oxidationszahlen
Der erste Schritt ist die Bestimmung der Oxidationszahlen, um herauszufinden was unsere Oxidation bzw. Reduktion ist.
- Kohlenstoff ist elementar und hat somit die Oxidationszahl null (0)
- Kupferoxid (CuO): Sauerstoff hat die Oxidationszahl minus zwei (-2) und Kupfer folglich die plus zwei (+2).
- Auf der rechten Seite ist Kupfer elementar und hat die Oxidationszahl null (0).
- Kohlenstoffdioxid (CO2): Sauerstoff hat wieder die Oxidationszahl minus zwei (-2). Da wir zwei Sauerstoffatome haben, hat der Kohlenstoff jetzt die Oxidationszahl plus vier (+4) haben.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Schritt 2: Bestimmen der Teilreaktionen
Jetzt kannst du bestimmen, welche Teilreaktion die Reduktion und welche die Oxidation ist:
- Oxidation: Kohlenstoff wird oxidiert: Seine Oxidationszahl erhöht sich von 0 (C) auf +4 (CO2).
- Reduktion: Kupfer wird reduziert: Seine Oxidationszahl verringert sich von +2 (CuO) auf 0 (Cu).
Schritt 3: Einzeichnen der übertragenen Elektronen
Nun kannst du die Teilgleichungen mit den übertragenen Elektronen ausgleichen.
- Oxidation: Hier erhöht sich Oxidationszahl von Kohlenstoff um vier (4). Kohlenstoff gibt also auch 4 Elektronen ab.
- Reduktion: Hier verringert sich die Oxidationszahl von Kupfer um zwei (2). Kupfer (Cu2+) nimmt also 2 Elektronen auf.
Schritt 4: Ladungsausgleich
Jetzt erfolgt der Ladungsausgleich. Dafür musst du zuerst wissen, ob die Reaktion im Neutralen, im Basischen oder im Sauren abläuft.
- Für den neutralen und sauren Bereich gleichst du mit H3O+ Ionen aus.
- Im basischen Bereich verwendest du OH–-Ionen.
Wenn keine Angabe in der Aufgabe steht, gehe am besten vom Neutralen aus.
Verwende hier also Oxonium-Ionen (H3O+) für den Ausgleich. Dafür schaust du dir bei beiden Teilgleichungen die Ladungen auf der linken und auf der rechten Seite an.
- Oxidation: Hier hast du links eine Ladung von ‚Null‘ . Rechts hast du wegen den vier Elektronen eine Ladung von ‚minus 4‘. Du schreibst also auf die negativere, rechte Seite noch 4 H3O+ -Ionen dazu. Dadurch ist die Ladung auch null.
- Reduktion: Links hast du eine Ladung von minus zwei und rechts eine von null. Also müssen wir links mit 2 H3O+ -Ionen ausgleichen.
Oxidation: C → CO2 + 4 e– + 4 H3O+
Reduktion: CuO + 2 e–+ 2 H3O+→ Cu
Schritt 5: Stoffausgleich
Der nächste Schritt ist der Stoffausgleich. Er erfolgt immer mit Wasser. Du schaust dir hierfür für jede der beiden Teilgleichungen an, wie Wasserstoff und Sauerstoff auf der linken bzw. rechten Seite verteilt sind.
- Oxidation: Hier hast du rechts vier mal drei, also 12 Wasserstoffatome und sechs Sauerstoffatome. Links befinden sich gar keine Wasserstoff- oder Sauerstoffatome. Du musst also mit so vielen H2O Molekülen auffüllen, damit die beiden Seiten identisch sind. In unserem Fall brauchst du sechs Wassermoleküle. Damit hast du auf beiden Seiten die gleiche Menge von Atomen.
- Reduktion: Bei der Teilreaktion funktioniert das genauso. Links hast du sechs Wasserstoff- und drei Sauerstoffatome. Rechts musst du drei Wassermoleküle hinzufügen, damit deine Gleichung stimmt.
Schritt 6: Ausgleich der Elektronen
Im sechsten Schritt musst du noch dafür sorgen, dass beide Teilgleichungen dieselbe Anzahl an Elektronen aufweisen.
Das bekommst du ganz einfach hin, indem du die Reduktionsgleichung mit zwei multiplizierst. Deine beiden Gleichungen sehen nun so aus:
Schritt 7: Addition der Teilgleichungen und Kürzen der Gesamtgleichung
Als letzten Schritt musst du nur noch aus diesen Teilgleichungen eine einzige Gesamtgleichung machen. Das wichtigste dabei ist, dass du weißt, was auf welche Seite kommt. Edukte zu Edukten und Produkte zu Produkten. Also alles was mal auf der linken Seite einer Teilgleichung stand, muss auch auf der linken Seite der Gesamtgleichung stehen. Das sieht dann so aus:
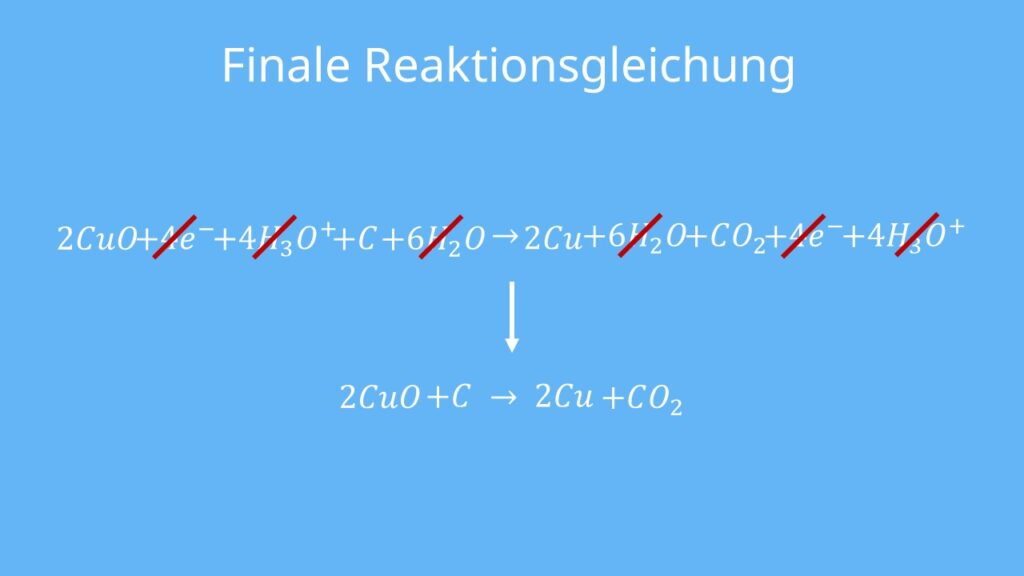
Das wirkt jetzt etwas kompliziert, aber wie auch in der Mathematik kannst du hier einiges kürzen — nämlich alles, was auf beiden Seiten gleich ist.
Die finale Reaktionsgleichung ist dann:
Mit diesem Vorgehen kannst du jede Reaktionsgleichung aufstellen.
Redoxreaktionen Übungen
Möchtest du dein erlerntes Wissen direkt anwenden? Dann schau mal in unseren Beitrag „Redoxreaktionen Übungen „! Dort findest du einige Beispiele, um die Schritte beim Aufstellen einer Redoxgleichung noch einmal in Ruhe zu üben.