Mehrphasengemische
Du durchlebst während der Prüfungszeit immer wieder verschiedene Lernphasen? Welche unterschiedlichen Phasen bei Gemischen vorkommen, erklären wir dir in diesem Beitrag.
Inhaltsübersicht
Raoult´sche Gesetz
Nachdem wir wissen, wovon wir bei Mehrphasengemischen sprechen, wollen wir uns den Gesetzmäßigkeiten zuwenden. Aus dem Video zur feuchten Luft kennst du ja bereits den Dampfdruck (p s Null) einer Flüssigkeit und, dass dieser im Gleichgewicht mit der Umgebung steht.
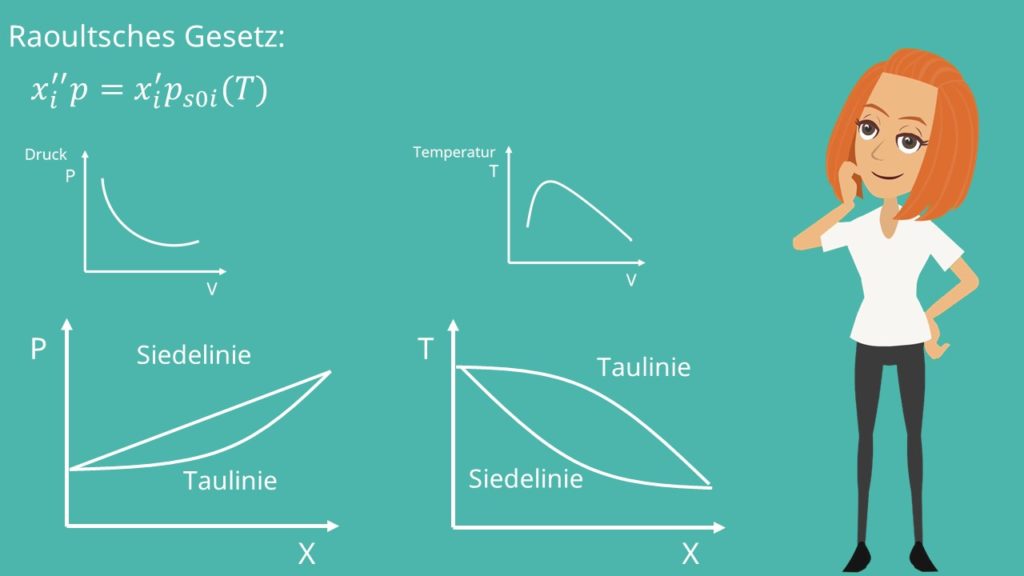
Für ideale Mehrphasengemische gilt das sogenannte Raoult´sche Gesetz mit:
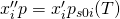
Wir betrachten also eine Komponente i des Gemisches. X i Strich Strich ist demnach der Anteil der Komponente i in der Gasphase und x i Strich der Anteil der Komponente i in der Flüssigphase. Das heißt, wenn wir den gesamten Druck, den Dampfdruck und zum Beispiel die Zusammensetzung der flüssigen Phase kennen, können wir uns einfach die Zusammensetzung der Gasphase berechnen.
Du hast sicher erkannt, dass uns in der Regel die Zusammensetzung der Gemische interessiert. Demnach können wir das p-v beziehungsweise das T-v-Diagramm in ein p-x beziehungsweise T-x-Diagramm umschreiben. Dabei können wir eine Taulinie und eine Siedelinie betrachten. Im p-x-Diagramm erhalten wir die Linien aus dem Raoult´schen Gesetz. Generell gilt für die Gasphase:
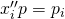
Wenn du dir das genau anschaust, ist das auch logisch: Xi Strich Strich ist der Anteil der Komponente i in der Gasphase und p der gesamte Druck. Damit also der Partialdruck der Komponente i. Im p-x-Diagramm tragen wir den gesamten Druck über den jeweiligen Anteil x einer der Komponenten auf. Also suchen wir jetzt den Gesamtdruck. Diesen erhalten wir aus der Summe über alle Partialdrücke.
Für die Siedelinie ist die Zusammensetzung der Flüssigphase bekannt und konstant. Damit ergibt sich für die Siedelinie:
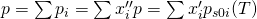
Für die Taulinie kennen wir nur die Zusammensetzung der Gasphase, also x i Strich Strich. Wir wissen, dass die Summe x i Strich gleich eins sein muss.
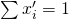
Zudem ergibt sich aus der Umformung des Raoult´schen Gesetz folgendes:
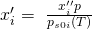
Diese beiden Erkenntnisse können wir nun zusammenführen:
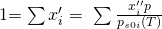
Das können wir wieder umformen und erhalten für die Taulinie:
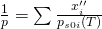
Für die Temperatur können wir das leider nicht so einfach machen. Hier haben wir keine Gesetzmäßigkeit, sodass wir für jedes Gemisch die Kurve der Tau- beziehungsweise Siedelinie experimentell bestimmen müssen.
Nun betrachten wir die beiden Diagramme nochmal etwas genauer. Für das p-x-Diagramm kennen wir die Formeln für die Tau- beziehungsweise Siedelinie aus dem Raoult‘schen Gesetz. Wichtig ist, dass wir immer die Komponente mit dem höheren Dampfdruck auftragen. Damit ist bei x gleich eins der Dampfdruck der betrachteten Komponente und bei x gleich Null der Dampfdruck der anderen Komponente. Beim p-x-Diagramm liegt die Flüssigphase oberhalb des Nassdampfgebiets und die Gasphase unterhalb des Nassdampfgebiets. Das liegt daran, dass bei höherem Druck „mehr Teilchen“ in die flüssige Phase gepresst werden. Das T-x Diagramm ist um 90 Grad gedreht. Allerdings sind hier Siedeline und Taulinie bauchige Kurven und die Zusammenhänge sind nicht so einfach wie beim Druck. Hier liegt die Gasphase oberhalb des Nassdampfgebiets.
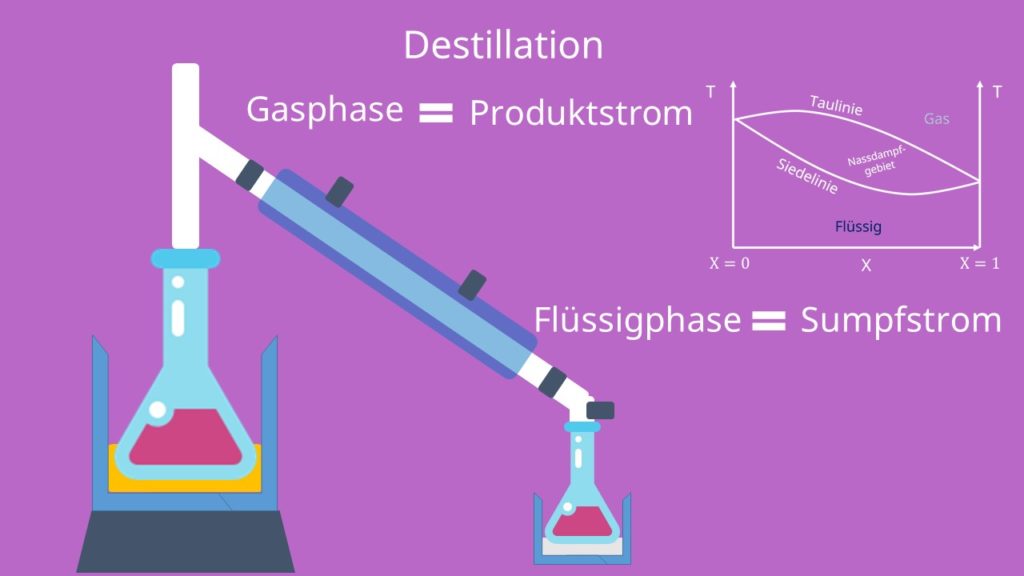
Mit Hilfe des Diagramms können wir auch Destillation graphisch darstellen. Bei der Destillation gehen wir mit einem sogenannten flüssigen Feed-Strom mit bestimmter Zusammensetzung in einen Phasentrenner. Hier wird das Gemisch erhitzt und die Gasphase – auch Produktstrom genannt-, und die Flüssigphase – auch Sumpfstrom genannt-, werden getrennt. Mit dem Produktstrom kann dann nach erneuter Verflüssigung wieder von vorne angefangen werden.
Nun weißt du, dass du nicht der Einzige bist, der am Tag mehrere verschiedene Phasen durchlebt. Viel Erfolg beim Lernen!