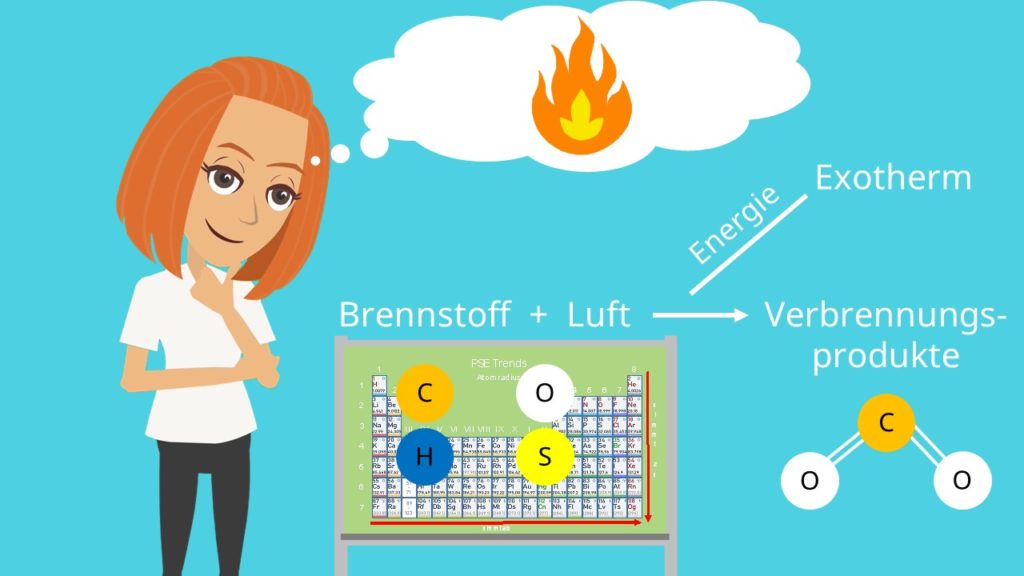
Verbrennung
Um mit deinem Auto fahren zu können, brauchst du Benzin, das im Motor verbrannt wird. Was es mit dieser Verbrennung auf sich hat, erklären wir dir in diesem Beitrag.
Inhaltsübersicht
Einleitung
Als erstes müssen wir verstehen, was eine Verbrennung überhaupt ist. Als Verbrennung bezeichnet man die Reaktion eines Gemisches aus Brennstoff und Luft. Daraus entstehen dann Verbrennungsprodukte, bei denen meist 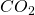 enthalten ist. Dabei ist eine Verbrennung immer exotherm, es wird also Energie frei. Nutzbare Brennstoffe sind Kohlenstoff, Wasserstoff, Sauerstoff und Schwefel. Diese liegen natürlich nicht als Element vor, sondern in einer Molekülverbindung. Benzin ist zum Beispiel ein Kohlenwasserstoff. Doch welche Bestandteile aus der Luft brauchen wir jetzt noch für eine Reaktion? Entscheidend ist für uns nur der Sauerstoff, alles andere können wir erst mal vernachlässigen.
enthalten ist. Dabei ist eine Verbrennung immer exotherm, es wird also Energie frei. Nutzbare Brennstoffe sind Kohlenstoff, Wasserstoff, Sauerstoff und Schwefel. Diese liegen natürlich nicht als Element vor, sondern in einer Molekülverbindung. Benzin ist zum Beispiel ein Kohlenwasserstoff. Doch welche Bestandteile aus der Luft brauchen wir jetzt noch für eine Reaktion? Entscheidend ist für uns nur der Sauerstoff, alles andere können wir erst mal vernachlässigen.
Bevor wir uns jetzt mit dem Reaktionsprozess beschäftigen, müssen wir noch eine einheitliche Schreibweise definieren. Wir machen das analog zur feuchten Luft und beziehen alles immer auf den Brennstoff – um genau zu sein auf ein Kilogramm oder ein Kilomol Brennstoff. Betrachten wir beispielsweise die Reaktion von Kohlenstoff und Sauerstoff:
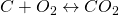
Ein Kilomol Kohlenstoff entsprechen zwölf Kilogramm und ein Kilomol „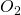 “ 32 Kilogramm Sauerstoff. Damit erhalten wir für die Masse von „
“ 32 Kilogramm Sauerstoff. Damit erhalten wir für die Masse von „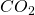 “ 44 Kilogramm. Um das nun auf ein Kilogramm Brennstoff zu reduzieren, müssen wir lediglich durch die Masse des Brennstoffs teilen. Dieser ist in unserem Fall der Kohlenstoff, wir teilen also durch 12. Damit erhalten wir ein Kilogramm Kohlenstoff, 2,7 Kilogramm Sauerstoff und am Ende 3,7 Kilogramm „
“ 44 Kilogramm. Um das nun auf ein Kilogramm Brennstoff zu reduzieren, müssen wir lediglich durch die Masse des Brennstoffs teilen. Dieser ist in unserem Fall der Kohlenstoff, wir teilen also durch 12. Damit erhalten wir ein Kilogramm Kohlenstoff, 2,7 Kilogramm Sauerstoff und am Ende 3,7 Kilogramm „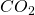 “. Diesen Bezug auf Kilogramm wollen wir im weiteren Verlauf beibehalten.
“. Diesen Bezug auf Kilogramm wollen wir im weiteren Verlauf beibehalten.
Vollständige Verbrennung
Wir wissen jetzt was eine Verbrennung ist und wie wir diese ausschreiben können. Damit können wir uns nun mit der Verbrennung selbst beschäftigen. Wir unterscheiden dabei in zwei Fällen: Die vollständige Verbrennung und die unvollständige Verbrennung. Betrachten wir zuerst die vollständige Verbrennung. Das heißt alles Brennbare verschwindet und die Produkte haben ihre höchste Oxidationszahl. Falls du nicht mehr ganz sicher bist, wie man Oxidationszahlen ermittelt, schau dir doch einfach nochmal unser Video zu Redoxreaktionen an. Geht die Reaktion komplett auf, bleibt also kein Sauerstoff übrig, sprechen wir von einer stöchiometrischen Verbrennung. Es kann sich aber auch um eine vollständige Verbrennung handeln, wenn Sauerstoff übrig bleibt.
Unvollständige Verbrennung
Damit kommen wir auch direkt zu unvollständigen Verbrennungen. Hier entstehen Produkte mit niedrigeren Oxidationsstufen, zum Beispiel C O. Das passiert immer dann, wenn nicht genug Sauerstoff vorliegt. Stell dir dafür eine Kiste voll mit C und O vor. Das gewünschte Produkt ist 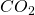 . Der Sauerstoff in der Kiste reicht jetzt aber nicht mehr aus, um alle Edukte zu C O zwei reagieren zu lassen. Die einzige Möglichkeit, die dem Kohlenstoff bleibt, ist sich mit einem einzigen Sauerstoff zu verbinden.
. Der Sauerstoff in der Kiste reicht jetzt aber nicht mehr aus, um alle Edukte zu C O zwei reagieren zu lassen. Die einzige Möglichkeit, die dem Kohlenstoff bleibt, ist sich mit einem einzigen Sauerstoff zu verbinden.
Daraus können wir ableiten, dass wir für die vollständige Verbrennung eine minimale Sauerstoffmenge benötigen. Das trifft wiederum genau auf den stöchiometrischen Fall zu, da hier ja kein Sauerstoff übrigbleibt. Ermitteln können wir diese Menge durch die Bruttoreaktionsgleichung, weil wir genau alle Edukte in Produkte umsetzen. In der Realität sieht das allerdings nicht so einfach aus. Bei Verbrennungen, wie beispielsweise dem Benzin im Auto, verwenden wir ja keinen reinen Sauerstoff, sondern Luft. Du weißt bestimmt schon, dass Stickstoff und Sauerstoff einen Großteil der Luft ausmachen. Wir nehmen die Anteile mit 79 Prozent Stickstoff und 21 Prozent Sauerstoff an. Alle anderen Bestandteile sind vernachlässigbar.
Das heißt der Anteil an Sauerstoff in der Luft ist dann:
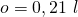
Für die Bewertung von Reaktionen ist das Luftverhältnis entscheidend. Dieses definieren wir uns als:
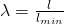
Wir benötigen also Ausdrücke für die Luftmenge und die minimale Luftmenge. Auf die minimale Luftmenge können wir über die minimale Sauerstoffmenge schließen. Durch Umstellen der Formel erhalten wir:
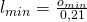
Die Luftmenge pro Brennstoff definieren wir uns zu:
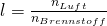
Damit wissen wir jetzt, wie wir uns das Luftverhältnis herleiten können. Dieses erlaubt uns eine Aussage darüber zu treffen, wie eine Reaktion abläuft. Bei Lambda kleiner eins haben wir zu wenig Luft und können nicht vollständig verbrennen. Ist Lambda genau eins haben wir die minimale Luftmenge und verbrennen damit stöchiometrisch. Bei Lambda größer eins haben wir einen Sauerstoffüberschuss und die Verbrennung läuft vollständig ab. Im Auto findest du die sogenannte Lambda-Sonde, die genau das misst und dafür sorgt, dass die Verbrennung vollständig abläuft.
Mit diesem Wissen verstehst du nun besser, was in einem Motor passiert. Im nächsten Video zeigen wir dir, wie du das Ganze anwenden kannst.