Verbrennung – Übung
Damit die Verbrennung in einem Motor möglichst reibungslos abläuft, suchen wir das optimale Mischungsverhältnis aus Luft und Brennstoff. Wie das genau funktioniert, erklären wir dir anhand einer Übung in diesem Beitrag!
Inhaltsübersicht
Einleitung
Im letzten Video hast du gelernt, was es mit Verbrennungen auf sich hat. Jetzt wollen wir dir erklären, wie du sie berechnen kannst. Als Beispiel betrachten wir die vollständige Verbrennung eines Generatorgases mit der folgenden Zusammensetzung:
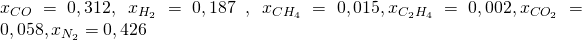
Dazu können wir wieder die Zusammensetzung von Luft mit einem Anteil von 21% Sauerstoff und 79% Stickstoff annehmen. Wir suchen jetzt die Luftmenge, die wir benötigen, damit die Verbrennung mit einem Lambda-Wert von 1,1 stattfindet.
Luftverhältnis
Wir wissen aus der Definition des Luftverhältnisses:
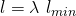
Auch die Definition für die minimale Luftmenge ist uns bekannt:
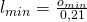
Eduktseite und Eduktströme
Das heißt wir suchen jetzt nur noch o min. Das finden wir mit Hilfe der Reaktionsgleichung. Dabei müssen wir darauf achten, dass die Bilanz stimmt. Dafür ist es wichtig, dass wir alle Stoffe betrachten, auch solche, die nicht reagieren. Auf der Eduktseite stehen somit alle Stoffe des Generatorgases. Wir beziehen uns jetzt auf ein Mol Brennstoff. Das heißt wir können direkt die Stoffmengenanteile übernehmen. Zusätzlich müssen wir für die Eduktseite noch die Luft betrachten, da diese auch an der Reaktion teilnimmt. Wir erhalten damit zusätzlich 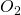 und
und 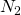 . Doch wie groß sind die Anteile der beiden Stoffe? Für den Sauerstoff wissen wir, dass er mit der minimalen Sauerstoffmenge reagiert, da wir genau diesen Wert suchen. Für den Stickstoff erhalten wir über die Anteile in der Luft den Zusammenhang:
. Doch wie groß sind die Anteile der beiden Stoffe? Für den Sauerstoff wissen wir, dass er mit der minimalen Sauerstoffmenge reagiert, da wir genau diesen Wert suchen. Für den Stickstoff erhalten wir über die Anteile in der Luft den Zusammenhang:

Somit haben wir alle Eduktströme bestimmt. Kommen wir nun zu den Produkten. Das Einzige, was wir wissen ist, dass wir nur 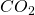 , Wasser und Stickstoff erhalten, da die Reaktion vollständig abläuft.
, Wasser und Stickstoff erhalten, da die Reaktion vollständig abläuft.
Produktseite und Produktströme
Die Anzahl der jeweiligen Stoffe im Produktstrom beschreiben wir mit Alpha, Beta und Gamma:
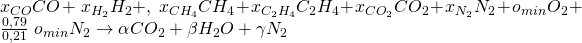
Um nun auf die Werte für Alpha, Beta und Gamma zu kommen, machen wir eine Elementenbilanz. Das heißt, dass die Anzahl der Teilchen vor und nach der Reaktion gleich sein muss. Wir stellen jetzt also für jedes Element eine Gleichung auf.
Der Sauerstoff beispielsweise kommt im CO einmal vor, im 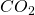 zwei Mal und im elementaren Sauerstoff der Luft zwei Mal. Bei den Produkten findet er sich zwei Mal im
zwei Mal und im elementaren Sauerstoff der Luft zwei Mal. Bei den Produkten findet er sich zwei Mal im 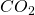 und einmal im Wasser.
und einmal im Wasser.
Elementbilanz
Analog ergibt sich für die anderen Elemente:
Damit erhalten wir ein lineares Gleichungssystem, das wir ganz einfach lösen können. Da das aber nur mathematischer Aufwand ist, ersparen wir dir das und kommen direkt zum Ergebnis:
Falls dir das jetzt zu schnell ging, schau dir doch einfach nochmal unser Video zu Linearen Gleichungssystemen an!
Setzen wir jetzt Alpha und Beta in die Gleichung für den Sauerstoff ein, ergibt sich:
Mit den Anteilen und den Werten für Alpha und Beta erhalten wir:
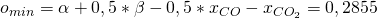
Damit ergibt sich dann für die minimale Luftmenge:
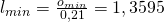
Über das Luftverhältnis können wir uns so die Luftmenge berechnen:
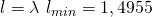
Das heißt: Für die Reaktion brauchen wir etwa 1,5 mal so viel Luft wie Brennstoff. Damit weißt du auch, wie man mit Verbrennungen umgeht. Viel Erfolg und bis bald!
