Eigenschaften von Wasser
Wasser hat eine große Bedeutung für das Leben auf der Erde. Welche zahlreichen besonderen Eigenschaften Wasser hat, erklären wir dir hier oder im kurzen Video!
Inhaltsübersicht
Eigenschaften des Wassers kurz erklärt
Die besonderen Eigenschaften von Wasser (H2O) sind für das Leben auf der Erde entscheidend. Das liegt vor allem am speziellen Aufbau der Wassermoleküle und den Kräften, die zwischen den einzelnen Wassermolekülen wirken.
So ermöglicht Wasser Lebensräume für viele Organismen. Wasser ist zudem Hauptbestandteil aller Lebewesen. Dort übernimmt es viele wichtige Funktionen, beispielsweise ist es ein Lösemittel für Nährstoffe, ein Transportmittel für viele Stoffe, zum Beispiel im Blut, oder hat eine Stützfunktion beispielsweise in den Blättern von Pflanzen.
Eigenschaften von Wasser – Überblick
Wasser hat spezielle Eigenschaften. Hier haben wir dir einige wichtige Eigenschaften von Wasser zum Überblick zusammengetragen:
- Wasser hat eine sehr hohe Schmelz- und Siedetemperatur (0° bzw. 100°).
- Eis hat eine geringere Dichte als flüssiges Wasser (Dichteanomalie des Wassers). Beim Erstarren werden das Volumen von Wasser also größer und die Dichte kleiner.
- Dank seiner Oberflächenspannung bildet Wasser Tröpfchen. Die Wasseroberfläche verhält sich wie eine dünne gespannte ‘Folie’.
- Die molare Masse von Wasser beträgt ungefähr 18 g/mol.
- Wasser besitzt eine hohe Schmelz- und Verdampfungsenthalpie.
Diese Eigenschaften von Wasser bilden die Grundlage des Lebens auf der Erde. Sie ermöglichten es auch, dass sich vor etwa 3,5 Milliarden Jahren die ersten Lebewesen entwickeln konnten.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Funktionen von Wasser – Überblick
Hier findest du die bedeutendsten Funktionen von Wasser auf einen Blick:
- Wasser ist ein Lebensraum für viele Organismen und stellt die Lebensgrundlage aller Lebewesen dar.
- Wasser ist Hauptbestandteil von Lebewesen, da Zellen zum größten Teil aus Wasser bestehen.
- Wasser dient als Lösemittel für Nährstoffe. Biochemische Reaktionen, wie die Fotosynthese oder die Zellatmung , können ohne Wasser nicht stattfinden.
- Wasser ist zudem ein wichtiges Transportmittel. Im Blut transportiert es unter anderem die Atemgase Sauerstoff und Kohlenstoffdioxid.
- Wasser ist an der Thermoregulation beteiligt. Unser Körper sondert Schweiß aus, um für Abkühlung zu sorgen.
- Wasser erfüllt zudem eine wichtige Stützfunktion. Die Blätter von Pflanzen werden dadurch beispielsweise in Form gehalten.
Wie ist Wasser aufgebaut?
Die chemischen und physikalischen Eigenschaften von Wasser sind in dem besonderen Aufbau des Wassermoleküls sowie den Kräften, die zwischen den Molekülen wirken, begründet.
Ein Wassermolekül besteht aus
- einem Sauerstoffatom (O)
- und zwei Wasserstoffatomen (H).
Dabei ist das Sauerstoffatom mit jeweils einem Wasserstoffatom über eine sogenannte Elektronenpaarbindung (kovalente Bindung)verknüpft. Im Wassermolekül hat das Sauerstoffatom dabei mehr Kraft und zieht die Elektronen eher zu sich. Sauerstoff ist also elektronegativer als Wasserstoff.
Deshalb entsteht am Sauerstoffatom eine negative Teilladung, an den Wasserstoffatomen eine positive. Da sich die Elektronegativitätswerte von Sauerstoff und Wasserstoff unterscheiden, bildet sich dabei eine sogenannte polare Atombindung.
Das Wassermolekül ist außerdem gewinkelt (104,5°). Deshalb entsteht ein negativer Ladungsschwerpunkt beim Sauerstoffatom und ein positiver beim Wasserstoffatom. Du bezeichnest Wasser daher auch als Dipol („zwei Pole“) bzw. Dipolmolekül. Wasser ist also eine polare Verbindung.
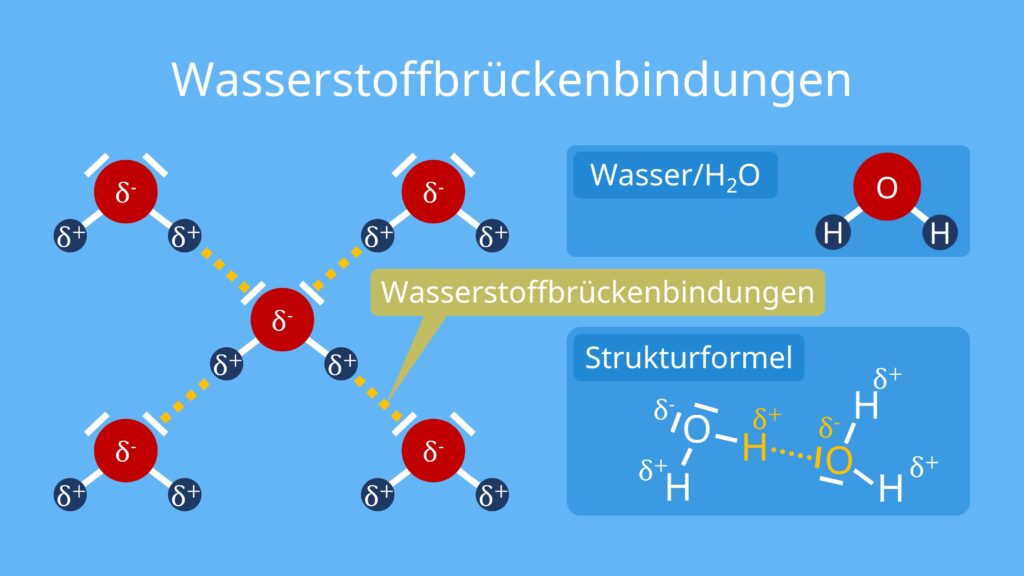
Wasserstoffbrückenbindungen
Einzelne Wassermoleküle können miteinander wechselwirken. Das liegt daran, dass das Wassermolekül ein Dipol ist, also zwei unterschiedliche Ladungsschwerpunkte hat. Wasserstoffatome und Sauerstoffatome ziehen sich somit gegenseitig an.
Die Anziehungskraft, die dabei entsteht, nennst du Wasserstoffbrückenbindung .
Jedes Wassermolekül kann mit bis zu vier weiteren Wassermolekülen eine solche Bindung eingehen. Im festen Aggregatzustand , also bei Eis, entstehen dabei sechseckige Kristallstrukturen.
Eigenschaften von Wasser – Im Detail
Hier bekommst du alle wichtigen physikalischen und chemischen Eigenschaften von Wasser ausführlich erklärt.
Aggregatzustände
Wasser ist der einzig bekannte Stoff, der auf der Erde in allen drei klassischen Aggregatzuständen vorkommt– fest, flüssig und gasförmig.
Im flüssigen Wasser bilden sich Verbände aus vielen Wassermolekülen, sogenannte Cluster. Sie werden durch Wasserstoffbrücken zusammengehalten. Ohne die Kräfte wäre Wasser bei Raumtemperatur gasförmig.
Schmelz- und Siedetemperaturen
Wasser hat eine vergleichsweise hohe Schmelztemperatur (0°C) und Siedetemperatur (100°C) bei Normaldruck. Andere Stoffe, die ähnlich schwer wie ein Wassermolekül sind, sieden und schmelzen viel früher. Die Siedetemperatur von Wasser müsste eigentlich bei unter -50°C liegen. Damit würde es kaum flüssiges Trinkwasser geben und Lebewesen könnten nicht überleben.
Der Grund für die hohen Schmelz- und Siedetemperaturen bei Wasser sind die starken Kräfte, die zwischen den Wassermolekülen wirken: die Wasserstoffbrückenbindungen. Deshalb wird viel Energie benötigt, um die Bindungen zu überwinden. Genau das ist nämlich beim Erhitzen nötig, damit ein Wasser-Molekül in die Gasphase übergehen kann.
Dichte
Beim Gefrieren steigt das Volumen von Wasser an, Eis hat also eine geringere Dichte als flüssiges Wasser. Ein Eisberg schwimmt deshalb oben. Er ist etwa 10% „leichter“ und ragt deswegen ungefähr 10% aus dem Wasser. Das Phänomen kommt zustande, da Eis als weitmaschiges Gitter aus Wassermolekülen vorliegt. Die Wasserstoffbrückenbindungen sorgen dafür, dass das Gitter fest zusammen gehalten wird.
Bei etwa 4 Grad Celsius (4°C) hat Wasser dann seine höchste Dichte, sie beträgt etwa ein Kilogramm pro Liter (1kg/l).
In der Natur spielt die Anomalie des Wassers eine lebenswichtige Rolle. Tiere und Pflanzen können dank der besonderen Eigenschaft von Wasser die kalten Wintertemperaturen überleben. Gewässer gefrieren nämlich nur oben an der Oberfläche. Es bildet sich eine isolierende Eisschicht.
Spezifische Wärmekapazität
Die spezifische Wärmekapazität von flüssigem Wasser ist sehr hoch. Sie liegt bei etwa 4,2 kJ/kg · K. Du benötigst also 4,2 Kilojoule an Energie, um ein Kilogramm Wasser um ein Kelvin zu erhitzen.
Wasser kann daher relativ viel Energie aufnehmen bzw. speichern. Deshalb wird Wasser auch als Wärmespeicher in Heizungen verwendet.
Verdampfungsenthalpie (Verdampfungswärme)
Auch die Verdampfungsenthalpie von Wasser ist größer als bei anderen Flüssigkeiten. Darunter verstehst du die Energie, die benötigt wird, um eine bestimmte Menge einer Flüssigkeit zu verdampfen. Das bedeutet, dass sie vom flüssigen in den gasförmigen Zustand überführt werden soll.
Das ist zum Beispiel wichtig für die Thermoregulation in deinem Körper. Überhitzt der Körper beispielsweise beim Sport, gibt er Schweiß über die Haut ab. Das Wasser im Schweiß verdampft, wobei viel Energie nötig ist. Die benötigte Energie wird aus der Umgebung aufgenommen. Dadurch entsteht der kühlende Effekt, den du auf deiner Haut spüren kannst.
Oberflächenspannung
Wasser hat eine große Oberflächenspannung. Das kommt daher, dass sich Wasserstoffbrückenbindungen zwischen den Molekülen ausbilden. So wird die Oberfläche des Wasservolumens möglichst klein gehalten. Die Eigenschaft des Wassers führt dazu, dass Wasser Tropfen bilden kann.
Bestimmte Insekten, wie der Wasserläufer, können sich daher auf der Oberfläche fortbewegen. Für uns Menschen ist die Oberflächenspannung bei der Tränenbildung von Bedeutung. Dadurch können Schmutz und Krankheitserreger gut abtransportiert werden.
Dielektrizitätskonstante
Die Polarität des Wasser ist sehr hoch. Das zeigt sich in seiner hohen Dielektrizitätskonstante. Dabei handelt es sich um eine Stoffkonstante, mit der du Eigenschaften bestimmter Lösungsmittel beschreiben kannst. Hat sie einen hohen Wert, handelt es sich um eine polare Verbindung.
Bei Wasser liegt die Dielektrizitätskonstante bei Raumtemperatur bei etwa 80, bei Benzin hingehen nur bei 2,3. Wasser ist daher ein gutes Lösungsmittel für ionische und andere polare Verbindungen.
Hydrathüllen
Stoffe, die sich in Wasser lösen, werden von Wassermolekülen umschlossen. Dabei bilden sich sogenannte Hydrathüllen. Das ist zum Beispiel bei Salzen , wie bei Natriumchlorid (NaCl), der Fall:
- Der positiv geladene Teil des Wassers, also die Wasserstoffatome, lagern sich dabei an die negativ geladenen Ionen, hierbei wäre das Chlorid (Cl–).
- Der negativ geladenen Teil des Wassers, also die Sauerstoffatome, wechselwirken mit den positiven Ionen, den Kationen, hier Natrium (Na+).
Die dabei wirkenden Kräfte nennst du Dipol-Ionen-Wechselwirkung.
Eigenschaften von Wasser – Zusammenstellung
Hier haben wir dir wichtige Eigenschaften von Wasser mit ihrer Bedeutung für das Leben auf unserem Planeten zusammengestellt:
| Eigenschaft | Besonderheit | Bedeutung |
|
Schmelz- und Siedetemperatur |
sehr hoch: 0 °C bzw. 100 ° C |
Wasser liegt als flüssiges Trinkwasser als Lebensgrundlage für Lebewesen vor |
| Aggregatzustände | kommt in allen drei Zuständen (fest, flüssig, gasförmig) auf der Erde vor | bietet für Lebewesen optimale Bedingungen |
| Dichte | höchste Dichte bei 4°C, Eis hat eine geringere Dichte als flüssiges Wasser | Gewässer gefrieren von oben nach unten zu, Überwinterung für viele Lebewesen möglich |
| Oberflächenspannung | sehr hohe Oberflächenspannung | Lebensraum für Insekten wie Wasserläufer (können sich fortbewegen), Tränenbildung beim Menschen |
| spezifische Wärmekapazität | sehr hoch: etwa 4,2 kJ/(kg·K) | Wasser als Wärmespeicher |
| Schmelzenthalpie | sehr hoch: 333,5 kJ/kg | Kühlender Effekt bei Eiswürfeln in Getränken |
| Verdampfungsenthalpie | sehr hoch: 2257 kJ/kg | Kühlender Effekt beim Schwitzen |
| Polarität | hohe Dielektrizitätskonstante | viele polare Stoffe und Ionen lösen sich in Wasser |
| Wärmeleitung | hoch für eine Flüssigkeit, aber klein im Vergleich zu Metallen | verschiedene Temperaturschichten in Seen im Sommer |
| pH-Wert | neutral | wichtig für viele Stoffwechselvorgänge; der pH-Wert im Blut liegt z.B. bei 7,4 |
Bedeutung von Wasser
Alle Eigenschaften des Wassers sorgen dafür, dass Leben auf unserem Planeten überhaupt erst möglich ist. In allen Lebewesen ist Wasser der Hauptbestandteil. So bestehen Quallen zu 98 Prozent aus Wasser, Pflanzen in der Regel zu mehr als 85 Prozent. Ein erwachsener Mensch besteht durchschnittlich bis zu 70 Prozent aus Wasser. Er nimmt über seine Nahrung und Getränke ungefähr 2500 – 3000 ml auf. Darüber hinaus scheidet er etwa 2300 ml Wasser täglich aus, etwa als Schweiß, Harn oder mit der Atemluft.
Als Trinkwasser dient Wasser uns Menschen als Lebensgrundlage. Es sollte deshalb frei von Verunreinigungen und Krankheitserregern sein. Deshalb muss es auch aufwändig aufbereitet werden.
Schon gewusst? 2020 lag der durchschnittliche Wasserverbrauch pro Kopf bei etwa 123 Litern pro Tag.
Wasserkreislauf
Das Wasser auf der Erde bewegt sich in einem Kreislauf — dazu gehören beispielsweise Regen und Flüsse. Wie der Wasserkreislauf funktioniert und welche Rolle der Mensch dabei spielt, erklären wir dir hier .