Gemische – Zustandsgrößen
Du hast den Wetterbericht gesehen und fragst dich, was es mit Tiefdruckgebieten auf sich hat? Wir erklären dir in diesem Beitrag wie du den Druck und andere Zustandsgrößen der Luft berechnen kannst.
Inhaltsübersicht
Ideales Gasgesetz
Nachdem wir im letzten Video die Massen- und Stoffmengenanteile bestimmt haben, wollen wir als nächstes wissen wie es sich mit dem Druck verhält. Für das ideale Gas gilt auch bei Gemischen das ideale Gasgesetz:
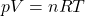
Gesetz von Dalton
P ist dabei der gesamte Druck des Gemisches. Um nun eine Aussage treffen zu können, brauchen wir das Gesetz von Dalton . Dieses besagt, dass jedes Gas im Gemisch den Raum so ausfüllt, als wäre es alleine. Das heißt, bei einem Behälter mit dem Volumen von einem Kubikmeter, nehmen Sauerstoff, Stickstoff und CO zwei jeweils einen Kubikmeter ein. Das Gemisch wird aber auch einen Kubikmeter einnehmen. Dies werden wir uns bei der weiteren Betrachtung zu Nutze machen. Wir wollen zunächst nur den Teil des Sauerstoffs betrachten. Hier gilt auch das ideale Gasgesetz – nur für die Sauerstoff-Komponente:
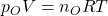
Setzen wir das ganze jetzt ins Verhältnis zum gesamten System, erhalten wir:
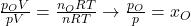
Da das Volumen des Gemisches dem Volumen der einzelnen Gase entspricht, können wir dieses direkt kürzen. Nach weiterem Kürzen ergibt sich somit:
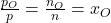
Volumen
Nach dem Druck betrachten wir das Volumen. Das gesamte Volumen ergibt sich als Summe der einzelnen Volumina. Im wissenschaftlichen Kontext ist allerdings meist das spezifische, beziehungsweise molare Volumen relevant. Wir wissen:
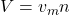
Setzen wir diese beiden Formeln gleich und drücken die einzelnen Volumina über das Molare Volumen aus erhalten wir:
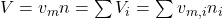
Um das Molare Volumen zu erhalten, teilen wir nun durch die Stoffmenge. Für die Summenformel ergibt sich damit:
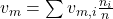
Der Term lässt sich wiederum vereinfachen zu:
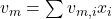
Praktisches Beispiel
Wir nehmen jetzt bei Sauerstoff ein molares Volumen von einem Kubikmeter pro Mol, bei Stickstoff 5 Kubikmeter pro Mol und bei CO zwei 4 Kubikmeter pro Mol an. Für die Stoffmengenanteile verwenden wir die Werte aus dem letzten Video:
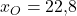
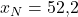
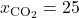
Damit ergibt sich das molare Volumen des gesamten Gemisches zu:
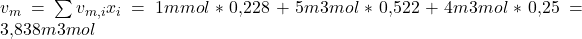
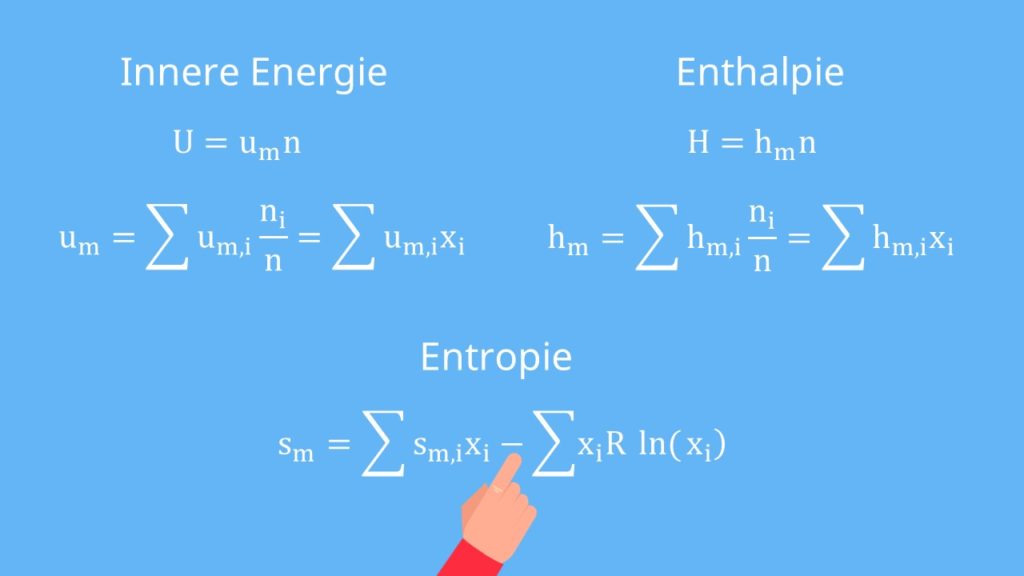
Innere Energie, Enthalpie und Entropie
Damit haben wir die Masse und das Volumen abgehakt. Für die innere Energie und die Enthalpie können wir nun analog vorgehen mit:
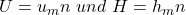
So erhalten wir ähnliche Formeln für die molare innere Energie und die Enthalpie:
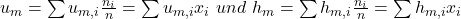
Für die Entropie können wir das nicht so leicht machen, da wir ja nicht einfach ein Stoffgemisch ohne Aufwand trennen können. Das heißt die Entropie muss steigen. Für die molare Entropie ergibt sich:
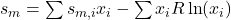
Lass dich dabei nicht vom Minus irritieren, der Ln ergibt einen negativen Wert. Somit wird der hintere Term positiv.
Du darfst jetzt allerdings nicht vergessen, dass wir eine ideale Betrachtung machen. Im realen erhalten wir gerade bei Flüssigkeiten andere Werte. Das hängt mit der Molekülgröße zusammen.
Reales Beispiel
Wenn wir jetzt zum Beispiel Erbsen und Sand mischen, ist das Volumen ja nicht die Summe von beiden, sondern etwas weniger. Das liegt daran, dass sich der Sand in die Zwischenräume der Erbsen legen kann. So ähnlich ist das auch bei realen Flüssigkeiten.
So, jetzt weißt du bestens Bescheid welche Zustandsgrößen der Luft es gibt und wie du sie berechnen kannst. Mach’s gut!