Gleichgewichtskonstante
Was sagt die Gleichgewichtskonstante bei chemischen Reaktionen aus und wie hängt sie mit dem Massenwirkungsgesetz zusammen? In diesem Artikel erklären wir dir, was die Gleichgewichtskonstante bedeutet, wie du sie berechnen kannst und wovon sie abhängig ist.
Du willst den Inhalt dieses Artikels in Form eines Videos verstehen? Dann schau dir gerne unser kurzes und verständliches Video zur Gleichgewichtskonstanten an.
Inhaltsübersicht
Gleichgewichtskonstante einfach erklärt
Die Gleichgewichtskonstante K gibt das Verhältnis der Konzentration aller an einer chemischen Gleichgewichtsreaktion beteiligten Stoffe an. Sie wird insbesondere in Zusammenhang mit dem Massenwirkungsgesetz verwendet. Deshalb wird sie oft auch als Massenwirkungskonstante, seltener als Equilibriumskonstante bezeichnet. Der Wert der Gleichgewichtskonstante hängt im Gegensatz zu der Lage des Gleichgewichts nur von der Temperatur ab und nicht von der Konzentration oder dem Druck.
Gleichgewichtskonstante K
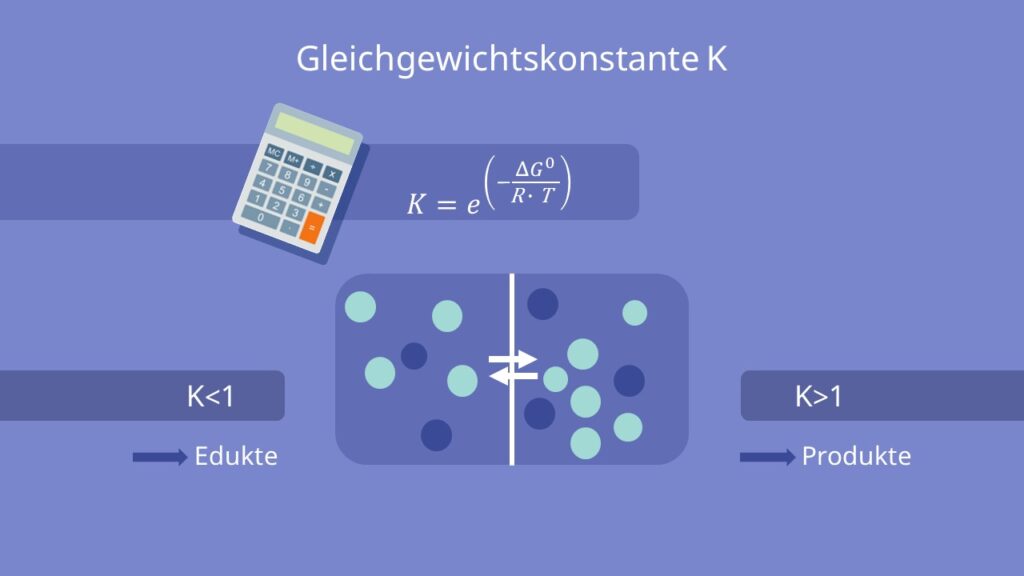
Die Gleichgewichtskonstante K ist bei konstanter Temperatur und konstantem Druck gegeben durch:

 bezeichnet hierbei die eulersche Zahl,
bezeichnet hierbei die eulersche Zahl,  die Standard-Gibbs-Energie
und
die Standard-Gibbs-Energie
und  die Gaskonstante. Die Temperatur
die Gaskonstante. Die Temperatur  muss immer in Kelvin angegeben werden.
muss immer in Kelvin angegeben werden.
Bei einem Wert von  befindet sich das Gleichgewicht dieser Reaktion auf Seite der Edukte. Bei einem Wert von
befindet sich das Gleichgewicht dieser Reaktion auf Seite der Edukte. Bei einem Wert von  liegt das Gleichgewicht auf der Seite der Produkte.
liegt das Gleichgewicht auf der Seite der Produkte.
Die Größe dieser Konstante kann nur durch Änderung einer äußeren Bedingung verändert werden – der Temperatur. Durch eine Temperatursenkung kannst du den Wert der Gleichgewichtskonstante in Richtung des exothermen Verlaufs verändern, durch eine Erhöhung entsprechend in die entgegengesetzte Richtung. Eine Änderung von Druck oder Konzentration kann zwar die Lage des Gleichgewichts verändern, die Größe der Gleichgewichtskonstante bleibt dabei jedoch gleich.
Den Zusammenhang von Temperaturänderung und Änderung der Gleichgewichtskonstante kannst du durch die sogenannte van’t hoff Gleichung beschreiben. Diese wird bei konstantem Druck  Reaktionsisobare genannt:
Reaktionsisobare genannt:

Bei einem konstanten Volumen wird sie Reaktionsisochore genannt:

 bezeichnet hierbei die Gaskonstante
,
bezeichnet hierbei die Gaskonstante
,  die innere Standardenergie und
die innere Standardenergie und  die Standardenthalpie. Die Temperatur
die Standardenthalpie. Die Temperatur  wird in Kelvin angegeben und die jeweiligen Indizes
wird in Kelvin angegeben und die jeweiligen Indizes  und
und  stehen für einen konstanten Druck und ein konstantes Volumen.
stehen für einen konstanten Druck und ein konstantes Volumen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Gleichgewichtskonstante Kc
Die Gleichgewichtskonstante  bezieht die Konzentrationen der reagierenden Edukte und Produkte mit ein.
bezieht die Konzentrationen der reagierenden Edukte und Produkte mit ein.
Betrachten wir folgende beispielhafte Gleichgewichtsreaktion. Hier reagieren A und B reversibel zu C und D. Dabei handelt es sich bei den Großbuchstaben um die Reaktionspartner und bei den Kleinbuchstaben um deren stöchiometrische Koeffizienten:

Die Konstante  lässt sich nun berechnen mit:
lässt sich nun berechnen mit:

Gleichgewichtskonstante Kp
Bei Vorliegen einer chemischen Reaktion mit ausschließlich gasförmigen Stoffen kannst du die Gleichgewichtskonstante  berechnen. Diese erhältst du durch Betrachtung der Partialdrücke dieser Stoffe.
berechnen. Diese erhältst du durch Betrachtung der Partialdrücke dieser Stoffe.

Die Formel dieser Konstante kannst du auch durch eine Kombination von  und der idealen Gasgleichung
und der idealen Gasgleichung
 .
.
Dann ergibt sich für  :
:

Zu beachten ist hier, dass die Temperatur in Kelvin angegeben wird. Die Buchstaben a, b, c und d stehen für „Hochzahlen“ der jeweiligen Edukte und Produkte.
Gleichgewichtskonstante Einheit
Die allgemeine chemische Gleichgewichtskonstante K ist immer dimensionslos, sie besitzt also keine Einheit, sondern gibt lediglich ein Verhältnis an. Die Dimensionen von  und
und  lassen sich nicht allgemein formulieren, da sie immer von den Einheiten der reagierenden Stoffe abhängen. Eine jedoch häufig vorkommende Einheit für
lassen sich nicht allgemein formulieren, da sie immer von den Einheiten der reagierenden Stoffe abhängen. Eine jedoch häufig vorkommende Einheit für  ist
ist  und für
und für 
 .
.
Gleichgewichtskonstante berechnen
Betrachten wir abschließend noch eine beispielhafte Berechnung jeweils für  und
und  .
.
Gegeben sei die Reaktion für das chemische Gleichgewicht von Iodwasserstoff:

Nach einiger Zeit stellt sich bei 490 °C ein konstantes Konzentrationsverhältnis von  Wasserstoff,
Wasserstoff,  Iod und
Iod und  Iodwasserstoff ein.
Iodwasserstoff ein.
Die Konstante  kannst du dann wie folgt berechnen:
kannst du dann wie folgt berechnen:

Da  liegt das Gleichgewicht auf der Seite der Produkte.
liegt das Gleichgewicht auf der Seite der Produkte.
Schau dir für eine ausführliche Berechnung von  am Beispiel der Ammoniaksynthese gerne unseren Artikel zum Massenwirkungsgesetz
an.
am Beispiel der Ammoniaksynthese gerne unseren Artikel zum Massenwirkungsgesetz
an.
Da alle reagierenden Stoffe in dieser Gleichgewichtsreaktion gasförmig sind, kannst du auch den Wert für die Konstante  berechnen.
berechnen.

Der Wert für die Gaskonstante  beträgt
beträgt  und der Wert für 490 °C in Kelvin beträgt
und der Wert für 490 °C in Kelvin beträgt  . Für die Werte von c,d,a und b müssen die Hochzahlen der jeweiligen Produkte und Edukte betrachtet werden.
. Für die Werte von c,d,a und b müssen die Hochzahlen der jeweiligen Produkte und Edukte betrachtet werden.
Du erhältst für  und
und  .
.
Eingesetzt ergibt sich:
 = 45,9
= 45,9
Wie du siehst entspricht der Wert von  in diesem Fall exakt dem Wert von
in diesem Fall exakt dem Wert von  .
.