Atome
Was sind Atome und was genau musst du dir darunter vorstellen? Wie ist ein Atom aufgebaut? Das erklären wir dir in dem folgenden Beitrag.
Um das Thema noch schneller zu verstehen, kannst du dir gerne unser Video dazu anschauen!
Inhaltsübersicht
Atome einfach erklärt
Atome bezeichnen die kleinsten Bestandteile aller Stoffe. Dabei lässt sich ein Atom mit chemischen Mitteln nicht weiter in kleinere Bestandteile zerlegen. Atome setzten sich aus den Protonen, Neutronen sowie den Elektronen zusammen. Protonen und Neutronen bilden den Atomkern, während die Elektronen die Atomhülle bilden. Dementsprechend besitzt jedes Atom einen Atomkern und eine Atomhülle.
Ein Atom ist der kleinste Bestandteil aller Stoffe und lässt sich mithilfe von chemischen Mitteln nicht weiter zerlegen.
Was sind Atome?
Der detaillierte Aufbau von Atomen ist äußerst komplex. Daher vereinfachst du beim betrachten eines Atoms die realen Gegebenheiten mithilfe von verschiedenen Atommodellen . Atome sind zudem sehr klein, sodass du dich in Größenordnungen von gerade mal mehreren hundert Pikometern befindest.
Du willst das Thema Atome einfach und kompakt erklärt bekommen? Dann schau dir jetzt unser Video Atome einfach erklärt an!
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Atombaustein
Früher wurde davon ausgegangen, dass ein Atom unteilbar wäre. Allerdings weißt du heute, dass Atome auf physikalischen Wegen teilbar sind. Atome bestehen aus Protonen, Neutronen und Elektronen. Protonen sind positiv, Neutronen neutral und Elektronen negativ geladen. Im neutralen Atom hast du zudem genau so viele Elektronen wie Protonen.
Schauen wir uns nun die Elementarladung
 der Elektronen und Protonen an. Diese Ladung hat die Einheit Coulomb
der Elektronen und Protonen an. Diese Ladung hat die Einheit Coulomb  .
.
Der Betrag der Elementarladung von Elektronen sowie Protonen beträgt  .
.
Da Elektronen negativ geladen sind, beträgt deine Elementarladung  . Die Elementarladung eines Protons beträgt dagegen
. Die Elementarladung eines Protons beträgt dagegen  .
.
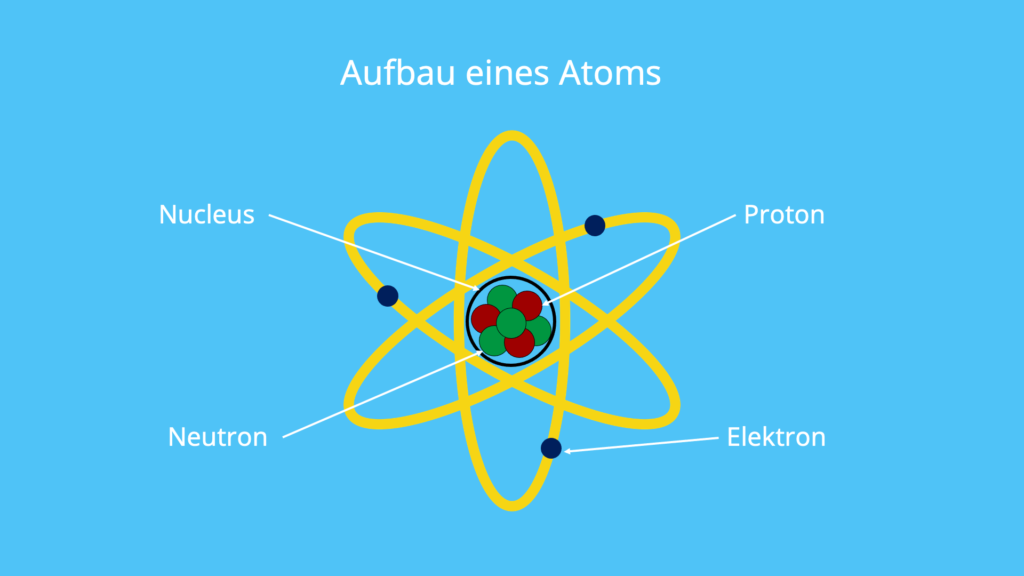
Aufbau eines Atoms
Wie sind deine Protonen, Neutronen sowie Elektronen im Atom überhaupt angeordnet? Deine Protonen und Neutronen befinden sich im Atomkern , also dem sogenannten Nucleus. Hingegen befinden sich deine Elektronen in der Atomhülle und kreisen um den Atomkern. Der Atomkern ist zwar um ein vielfaches kleiner als die Atomhülle, beherbergt aber mehr als 99,9 % der Masse des gesamten Atoms.
Nun zum Periodensystem , das ganz nah mit dem Aufbau eines Atoms zusammenhängt. Im Periodensystem sind deine Atome nach der Ordnungszahl geordnet. Die Ordnungszahl gibt dir die Anzahl der Protonen an und ist für alle Atome desselben Elements gleich. Die Massenzahl setzt sich aus der Anzahl von Protonen und Neutronen im Kern zusammen und ist im Periodensystem ebenfalls angegeben.
Ordnungszahl = Protonenanzahl
Massenzahl = Protonenanzahl + Neutronenanzahl
Die Masse eines Atoms setzt sich näherungsweise aus der Masse der Protonen sowie der Neutronen zusammen, also der Kernmasse. Hierbei kannst du die Masse eines Elektrons vernachlässigen, da sie etwa um das 2000-fache kleiner ist als die Kernmasse. Massen von Atomen gibst du in der atomaren Masseneinheit
 in
in  an.
an.

Ein Nuklid
, also ein Atom, hat eine Ordnungszahl und eine Massenzahl. Die atomare Masseneinheit ist als einem zwölftel der Masse des Kohlenstoffnuklids mit der Massenzahl 12 und der Ordnungszahl 6 (12C) definiert. Der Zahlenwert von  entspricht somit annährend der Massenzahl.
entspricht somit annährend der Massenzahl.
Das Kohlenstoffisotop 12C hat 6 Protonen und 6 Neutronen. Definitionsgemäß entspricht die atomaren Masseneinheit einem zwölftel der Masse des 12C.
Dein Wissen zu Nukliden kannst du nochmal in unserem Video auffrischen.
Du setzt die Atommassen aller anderen Atome in Relation zu einem zwölftel der Masse des 12C. In diesem Fall sprichst du auch von relativen Atommassen  . Dein Kohlenstoffnuklid hat somit eine relative Atommasse von
. Dein Kohlenstoffnuklid hat somit eine relative Atommasse von  .
.
Deine Neutronen im Atomkern besitzen keine Ladung, sind also neutral. Jedoch kann ein Element eine verschiedene Anzahl an Neutronen aufweisen. Elemente mit gleicher Kernladungszahl, also Anzahl an Protonen, aber unterschiedlicher Neutronenanzahl nennst du Isotope.
Schaue dir zum Thema Isotope gerne hier unser Video an.
Elektronenhülle Atome
Da sich die Chemie primär mit der Elektronenhülle beschäftigt, ist es äußerst wichtig, dass wir uns die Elektronenhülle zusammen angucken. Dabei kannst du die Elektronenhülle mit verschiedenen Modellen darstellen wie beispielsweise dem Schalenmodell oder auch dem Orbitalmodell.
Noch mehr Modelle den Aufbau des Atoms findest du im Video über Atomaufbau.
Schalenmodell Atome
Eine bekannte Möglichkeit, die Elektronenhülle der Atome modellhaft darzustellen, ist das Schalenmodell. Im Schalenmodell bewegen sich deine Elektronen in kreisförmigen Schalen um deinen Atomkern. Dabei ist dein Atomkern der Mittelpunkt aller Schalen.
Mit dem Schalenmodell kannst du schon viele Phänomene aus der Chemie erklären. Beispielsweise zeigt das Schalenmodell, dass Elektronen nur bestimmte Energiezustände besitzen können. Die bestimmten Energiezustände ergeben sich aus dem Abstand des Elektrons vom Kern in der jeweiligen Schale. Es können von den Elektronen nur bestimmte Abstände zum Kern eingenommen werden.
Gucken wir uns nun gemeinsam die wichtigsten Schalen an, die du kennen solltest. Deine erste Schale kann zwei Elektronen beinhalten und wird als K-Schale bezeichnet. Deine zweite Schale nennst du L-Schale und hat Platz für acht Elektronen. Die dritte Schale wird M-Schale genannt, in welcher du achtzehn Elektronen platzieren kannst.
Wie die weitere Namen der jeweiligen Schalen sind und wie du herausfindest, wie viele Elektronen in die jeweilige Schale passen, erfährst du in unserem Video zum Schalenmodell .
Orbitalmodell Atome
Das Schalenmodell ist jedoch ein sehr veraltetes Modell, in dem du davon ausgehst, dass du den genauen Aufenthaltsort kennst. Die Bestimmung des genauen Aufenthaltsort eines Elektrons ist aber aufgrund der Heisenbergschen Unschärferelation unmöglich. Das Orbitalmodell berücksichtigt die Heisenbergsche Unschärferelation jedoch. Nach dem Orbitalmodell hält sich ein Elektron nur mit einer gewissen Wahrscheinlichkeit in einem Orbital auf.
Mit der Schrödingergleichung kannst du auf den Aufbau und das Aussehen eines Orbitals schließen. Weitere Informationen zum Orbitalmodell , dem Aussehen von Orbitalen und Quantenzahlen findest du in diesem Video.
Oktettregel Atome
Kommen wir zum Schluss zur Oktettregel . Die Oktettregel besagt, dass Atome dazu streben, acht Elektronen in ihrer Valenzschale zu tragen. Dadurch erreichst du nämlich die energetisch günstige Edelgaskonfiguration.
Ein Atom kann die Oktettregel auf verschiedene Art uns Weisen erfüllen. Zum einen gibt es bereits die Edelgase, die im neutralen Zustand die Oktettregel erfüllen. Andererseits kannst du die Oktettregel auch erfüllen, indem dein Atom Elektronen aufnimmt oder abgibt. In diesem Fall bildest du aus deinem Atom ein Ion. Zudem kannst du die Oktettregel mit der Bildung von Molekülen ebenfalls erfüllen.
Schau dir unser Video zur Oktettregel an, falls du mehr über dieses Thema wissen möchtest.