Thermodynamische Potentiale
Damit dein Kaffee morgens schmeckt, muss sich die Milch mit dem Kaffee richtig vermischen. Dazu brauchen wir thermodynamische Potentiale. Was das ist, erklären wir dir in diesem Beitrag.
Inhaltsübersicht
Einleitung
Doch was sind diese thermodynamischen Potentiale? Potentiale sind dir sicher schon aus der Mechanik bekannt. Ähnlich werden sie auch in der Thermodynamik verwendet. Du kannst dir ein Thermodynamisches Potential als treibende Kraft zum Gleichgewichtszustand vorstellen. Dabei verändern sich die Zustandsgrößen solange bis das Gleichgewicht hergestellt ist. In der Mechanik hatten wir einen Gleichgewichtszustand, wenn sich die potentielle Energie über den Ort nicht mehr ändert, das heißt die Ableitung gleich Null ist. Wir machen jetzt das Gleiche, nur das wir die zeitliche Änderung betrachten wollen.
Potenziale
Und welche Potentiale gibt es nun? Dazu überlegen wir uns welche Arten von Gleichgewicht wir kennen. Das bekannteste Gleichgewicht ist das mechanische. Betrachten wir dafür jetzt einen abgeschlossenen Kolben mit zwei verschiedenen Drücken auf jeder Seite. Der Kolben wird sich jetzt so lange bewegen, bis der Druck auf beiden Seiten gleich ist. Dabei wird sich das Volumen von beiden Kammern ändern. Das heißt der Druck ist die treibende Kraft für den Ausgleichprozess und wir haben unser erstes Potential gefunden.
Thermisches Gleichgewicht
Als nächstes betrachten wir das thermische Gleichgewicht. Dafür schauen wir uns wieder den Kolben an, nur diesmal ist die Temperatur unterschiedlich. Es fließt jetzt ein Wärmestrom zwischen den beiden Kammern bis die Temperatur gleich ist. Damit ist die Temperatur unser zweites Potential.
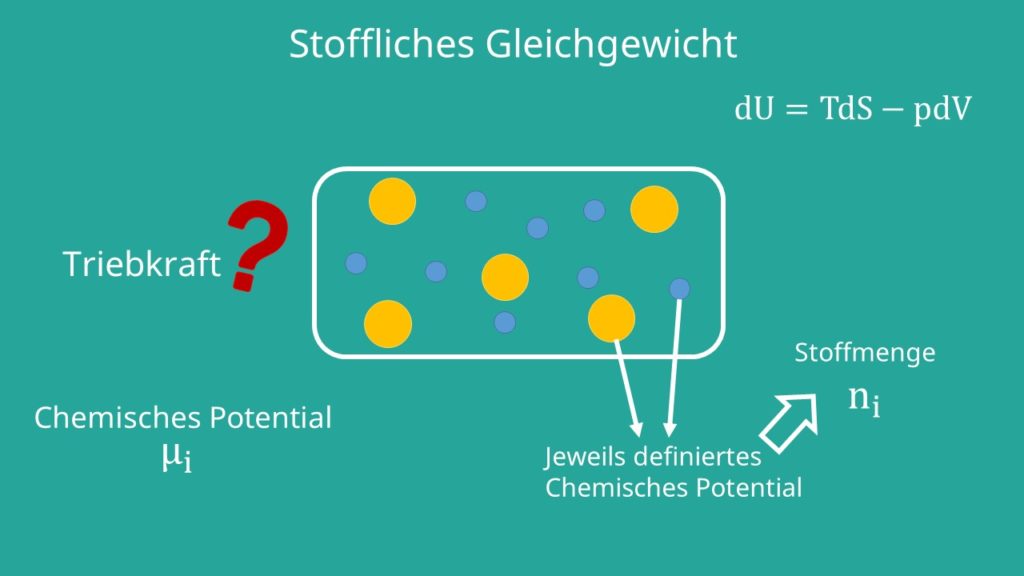
Stoffliches Gleichgewicht
Als letztes kennen wir noch das stoffliche Gleichgewicht. Es geht jetzt also um die Zusammensetzung. Dafür betrachten wir eine Kammer, die in der Mitte getrennt ist. Auf beiden Seiten befinden sich Gase unterschiedlicher Zusammensetzung. Entfernen wir die Trennung, werden sich die beiden Gase mischen, bis die Zusammensetzung gleich ist. Das heißt wir suchen jetzt die Triebkraft für stoffliches Gleichgewicht. Das definieren wir uns als:
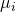
Fundamentalgleichung
Sie wird chemisches Potential genannt. Dabei hat jede Komponente ein definiertes chemisches Potential, das einen Einfluss auf die Stoffmenge n hat. Betrachten wir die Fundamentalgleichung, sehen wir, dass analog dazu die Temperatur T einen Einfluss auf die Entropie S und der Druck p einen Einfluss auf das Volumen V hat:
Wenn wir Gemische betrachten, können wir unsere Fundamentalgleichung ergänzen:
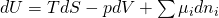
Wir können uns d U als totales Differential vorstellen. Dafür leiten wir partiell ab und multiplizieren mit der differentiellen Größe, nach der wir abgeleitet haben:
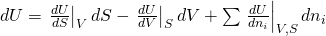
Änderung der inneren Energie
Betrachten wir jetzt die Änderung der inneren Energie, wenn wir eine Komponente hinzufügen. Zunächst kommt innere Energie durch den Stoff selbst hinzu. Damit erhöht sich natürlich auch das Volumen. Über den Druck erhalten wir hier weitere Energie. Durch die dem Stoff eigene Entropie erhöht sich auch die Gesamtentropie des Systems. Mit dem Anstieg an Entropie verringert sich allerdings der Zuwachs an Energie. Dies wird durch das negative Vorzeichen gekennzeichnet.
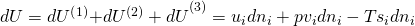
Dividieren wir jetzt durch „d n i“, erhalten wir:
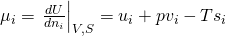
Erinnern wir uns jetzt an die Definition der Enthalpie:
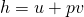
erhalten wir:
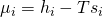
Das heißt, das chemische Potential ist auch abhängig von der jeweiligen Enthalpie und Entropie. Wie wir das chemische Potential noch definieren können, zeigen wir dir im nächsten Video.
Wenn wir jetzt wieder den Kaffee vom Anfang des Videos betrachten, können wir erstmal von konstantem Druck und konstanter Temperatur ausgehen. Damit bleibt nur noch das chemische Potential, das dafür sorgt, dass der Kaffee und die Milch sich ordentlich mischen.