Aktivierungsenergie
In diesem Beitrag erfährst du, welche Bedeutung die Aktivierungsenergie in der Chemie hat und wie du sie berechnen kannst.
Du willst den Inhalt dieses Beitrags in audiovisueller Form verstehen? Dann schau dir gerne unser zugehöriges Video zum Thema an.
Inhaltsübersicht
Aktivierungsenergie einfach erklärt
Als Aktivierungsenergie kannst du dir die Energie vorstellen, die nötig ist, um eine Reaktion in Gang zu setzen.
In der Chemie ist die Aktivierungsenergie besonders bei exothermen (bei einer Reaktion wird Energie frei) und endothermen Reaktionen (bei einer Reaktion wird Energie verbraucht) relevant. Außerdem hängt die Aktivierungsenergie eng mit der Reaktionsgeschwindigkeit zusammen. Hier spielen insbesondere Katalysatoren eine große Rolle. Katalysatoren können die Aktivierungsenergie senken und so die Wahrscheinlichkeit für einen Start der Reaktion steigern.
Berechnen kannst du die Aktivierungsenergie über folgende Formel:

Die Aktivierungsenergie wurde 1889 vom schwedischen Chemiker Svante August Arrhenius geprägt. Sie beschreibt eine energetische Barriere, die bei einer chemischen Reaktion überwunden werden muss, um die Reaktion in Gang zu setzen.
Aktivierungsenergie in der Chemie
Die Aktivierungsenergie  ist eine wichtige Größe besonders in der Chemie. Sie gibt die „energetische Barriere“ an, die überwunden werden muss, damit eine Reaktion überhaupt ablaufen kann.
ist eine wichtige Größe besonders in der Chemie. Sie gibt die „energetische Barriere“ an, die überwunden werden muss, damit eine Reaktion überhaupt ablaufen kann.
Somit ist sie erforderlich, um ein Teilchen wie ein Atom oder Molekül von einem Energieniveau auf ein anderes Energieniveau zu bringen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Exotherm und Endotherm
Je nachdem, auf welches Energieniveau du das Reaktionsprodukt bringst, kannst du zwischen einer exothermen und einer endothermen Reaktion unterscheiden.
Bei einer exothermen Reaktion liegen die Produkte energetisch niedriger als die Edukte. Aus diesem Grund wird Energie (Reaktionsenthalpie
)  frei und an die Umgebung abgegeben. Damit die exotherme Reaktion jedoch überhaupt gestartet werden kann, benötigen die Edukte jedoch noch eine gewisse Aktivierungsenergie
frei und an die Umgebung abgegeben. Damit die exotherme Reaktion jedoch überhaupt gestartet werden kann, benötigen die Edukte jedoch noch eine gewisse Aktivierungsenergie  .
.
Eine exotherme Reaktion kann zum Beispiel bei einem Lagerfeuer finden. Das Holz (Edukt) hat am Anfang ein bestimmtes Energielevel, es reagiert also nicht von alleine. Wenn du dem System mithilfe deines Feuerzeugs zuführst, kann es die Aktivierungsenergie überwinden. Bei dieser Reaktion wird Energie in Form von Wärme an die Umgebung abgegeben, weshalb es sich um eine exotherme Reaktion handelt.
Du kannst den Energieverlauf dieser Reaktion sehr gut in einem sogenannten Energiediagramm darstellen:
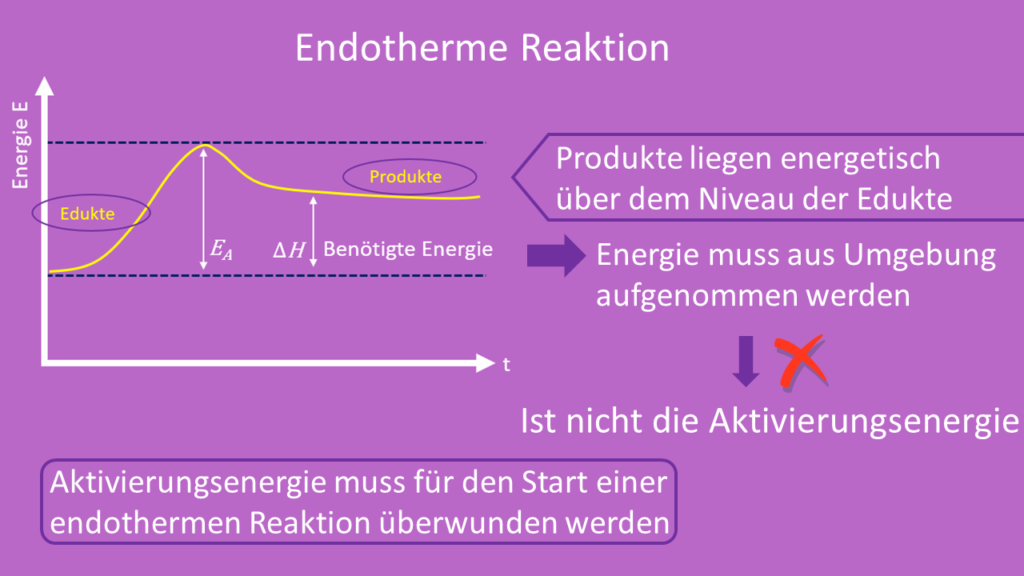
Die Produkte in einer endothermen Reaktion liegen energetisch über dem Niveau der Edukte. Deshalb muss während einer endothermen Reaktion Energie  aus der Umgebung aufgenommen. Diese aufgenommene Energie ist jedoch nicht die Aktivierungsenergie. Sie muss für den Start einer endothermen Reaktion trotzdem überwunden werden.
aus der Umgebung aufgenommen. Diese aufgenommene Energie ist jedoch nicht die Aktivierungsenergie. Sie muss für den Start einer endothermen Reaktion trotzdem überwunden werden.
Einfluss auf die Reaktionsgeschwindigkeit
Neben der Bedeutung für exotherme und endotherme Reaktionen ist die Aktivierungsenergie ebenfalls für die Reaktionsgeschwindigkeit einer Reaktion, wichtig.
Wenn sie hoch ist, ist die Geschwindigkeit der Reaktion verhältnismäßig klein. Bei einem geringeren Wert für  ist die Reaktionsgeschwindigkeit entsprechend geringer.
ist die Reaktionsgeschwindigkeit entsprechend geringer.
Du musst dabei aber beachten, dass die Aktivierungsenergie kein direktes Maß für die absolute Reaktionsgeschwindigkeit ist. Bei einem höheren  sinkt die Wahrscheinlichkeit, die Mindestenergie zu überwinden. Deshalb braucht die Reaktion für den Start länger, die absolute Geschwindigkeit von Edukt zum Produkt bleibt jedoch gleich.
sinkt die Wahrscheinlichkeit, die Mindestenergie zu überwinden. Deshalb braucht die Reaktion für den Start länger, die absolute Geschwindigkeit von Edukt zum Produkt bleibt jedoch gleich.
Bei einer niedrigeren Aktivierungsenergie  kann erfolgt eine Überwindung der Mindestenergie schneller wodurch die Wahrscheinlichkeit für eine Reaktion gesteigert wird.
kann erfolgt eine Überwindung der Mindestenergie schneller wodurch die Wahrscheinlichkeit für eine Reaktion gesteigert wird.
Katalysator
Um die Aktivierungsenergie zu erniedrigen, kannst du einen sogenannten Katalysator verwenden. Er kann dadurch die Reaktion indirekt beschleunigen, ohne dabei selbst verbraucht zu werden.
Beispiele für Katalysatoren sind das Gemisch aus Aluminiumoxid und Eisen beim Haber Bosch Verfahren oder der Platin-Rhodium-Katalysator beim Ostwald Verfahren .
Aktivierungsenergie berechnen
Du kannst die Aktivierungsenergie im Zusammenhang mit der Geschwindigkeitskonstanten  und der Temperatur
und der Temperatur  berechnen. Außerdem benötigst du zwei Konstanten, die sogenannte Gaskonstante
berechnen. Außerdem benötigst du zwei Konstanten, die sogenannte Gaskonstante
 und den Frequenzfaktor
und den Frequenzfaktor  .
.
Zusammengeführt werden diese Variablen in der sogenannten Arrhenius-Gleichung:

Wenn du die Gleichung logarithmierst und durch  teilst, erhältst du:
teilst, erhältst du:

Multipliziert mit  kommst du auf folgende Form:
kommst du auf folgende Form:

Aktivierungsenergie Einheit
Wenn du die Einheiten innerhalb der obigen Gleichung betrachtest, kannst du auf die Einheit der Reaktionsenergie schließen. Die Gaskonstante  hat die Einheit
hat die Einheit  . Die Temperatur
. Die Temperatur  hat die Einheit K. Die Reaktionsgeschwindigkeitskontante
hat die Einheit K. Die Reaktionsgeschwindigkeitskontante  und der Frequenzfaktor
und der Frequenzfaktor  haben keine Einheiten.
haben keine Einheiten.
Durch Einsetzen in obige Gleichung erhältst du für die Aktivierungsenergie die Einheit  .
.
Aktivierungsenergie Enzyme
Während in der Chemie oft verschiedenste Verbindungen als Katalysatoren genutzt werden, verwendet man in der Biochemie vor allem sogenannte Enzyme. Enzyme sind Biokatalysatoren , die in der Lage sind, die Aktivierungsenergie herabzusetzen und so die Reaktionsgeschwindigkeit indirekt zu erhöhen.
Die Enzyme binden ein Substat in ihrem sogenannten aktiven Zentrum. Sie sind in der Lage, diese Substrate „festzuhalten„, sodass sie leichter aufgebrochen werden und neu gebildet werden können.
Enzyme weisen eine gewisse Temperaturabhängigkeit auf. Bei einer Erhöhung der Temperatur können sich die Enzyme schneller bewegen und nehmen so die zugehörigen Substrate schneller auf. Diese Temperaturabhängigkeit kannst du durch die sogenannte RGT Regel beschreiben.
Aktivierungsenergie Halbleiter
Die Aktivierungsenergie spielt nicht nur in der Chemie und der Biologie, sondern auch in der Elektrotechnik eine wichtige Rolle.
Bei einem undotierten Halbleiter ist es die Energie, die benötigt wird, um eine Elektron als freien Ladungsträger zu gewinnen. Du kannst dir  hier als den Abstand zwischen Leitungsband und Valenzband, die sogenannte Bandlücke, vorstellen.
hier als den Abstand zwischen Leitungsband und Valenzband, die sogenannte Bandlücke, vorstellen.
Bei einem dotierten Halbleiter (p- und n- Halbleiter) benötigst du weniger Energie, um einen freien Ladungsträger zu gewinnen. Die Dotieratome bilden Energieniveaus in der Bandlücke.  ist dann der Unterschied der Energieniveaus und dem nächstgelegenen Band.
ist dann der Unterschied der Energieniveaus und dem nächstgelegenen Band.