Metallbindung
Die Metallbindung oder metallische Bindung ist eine chemische Bindungsart. Was eine Metallbindung genau ist, wie sie entsteht und wo sie vorkommt, erklären wir dir hier im Beitrag und im Video mit Beispielen.
Inhaltsübersicht
Was ist eine Metallbindung?
Eine Metallbindung (auch metallische Bindung oder ungerichtete Bindung) ist eine Bindung von Metallen, die ihre Valenzelektronen zur Verfügung stellen und somit ein Elektronengas bilden. Das Elektronengas kann von allen beteiligten Metallatomen genutzt werden, um die Edelgaskonfiguration zu erreichen.
Die Elektronen im Elektronengas sind frei beweglich. Das führt auch zu den typischen metallischen Eigenschaften: elektrische Leitfähigkeit, Verformbarkeit und metallischer Glanz.
Du findest eine metallische Bindung bei Metallen wie beispielsweise Lithium (Li) oder Natrium (Na). Auch in Legierungen wie Bronze, also einem Gemisch aus mindestens einem Metall, kommt so eine Metallbindung vor.
Die Metallbindung oder metallische Bindung ist eine chemische Bindungsart, die bei Metallen und in Legierungen vorkommt. Sie kommt durch die elektrostatische Anziehung zwischen Metall-Kationen und ihren frei beweglichen Elektronen, dem Elektronengas, zustande.
Wie entsteht eine Metallbindung?
Allgemein entsteht die Metallbindung durch Anziehungskräfte zwischen den positiv geladenen Metall-Kationen (Atomrümpfe) und den negativ geladenen Elektronen der Metalle. Die Elektronen umschließen die positiven Ionen und sorgen für den Zusammenhalt im Metall. Du kannst dir die Metall-Ionen wie Murmeln vorstellen, die in einer Schachtel, den Elektronen, zusammengepackt vorliegen.
Für die Entstehung der Metallbindung gibt es zwei Modelle:
- das Elektronengasmodell
- das Bändermodell
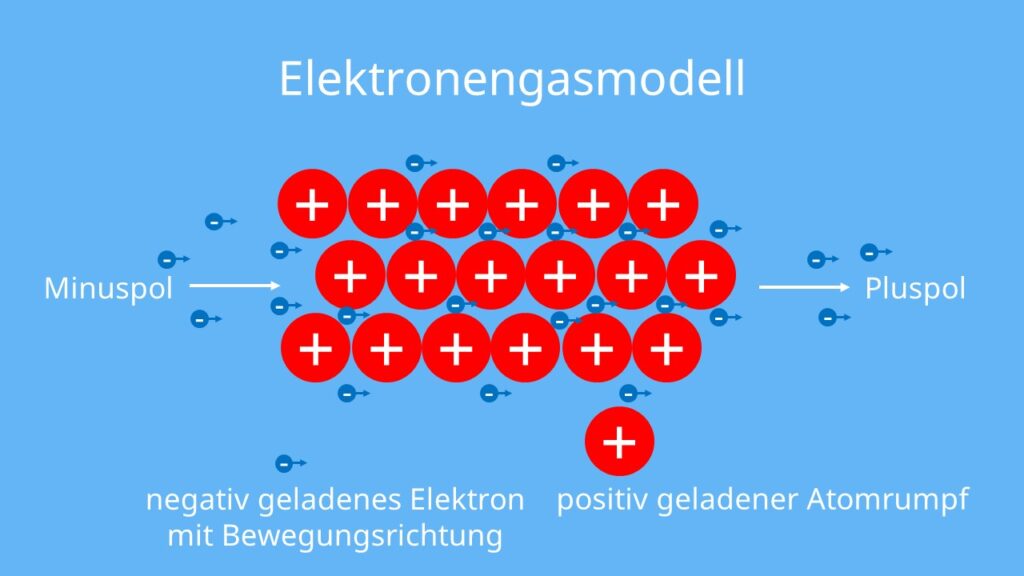
Elektronengasmodell
Das Elektronengasmodell ist ein ‚einfaches‘ Modell, um die Metallbindung zu beschreiben. Du kannst es dir folgendermaßen vorstellen:
- Die äußeren Elektronen (Valenzelektronen ) der Metallatome sind nur sehr schwach gebunden. Daher neigen Metalle dazu, diese abzugeben, um eine stabile Edelgaskonfiguration zu erreichen.
- Durch die Elektronenabgabe liegen die Metalle als positiv geladene Ionen (Kationen ) vor. Die Metall-Kationen bezeichnest du auch als Atomrümpfe.
- Die Atomrümpfe sind regelmäßig angeordnet, in einem sogenannten Metallgitter.
- Die von den Metall-Ionen abgegebenen Elektronen sind frei beweglich. Sie können also von einem Ende zum anderen Ende des Metalls ‚wandern‘. Ihre Bewegung ist außerdem ungeordnet (delokalisiert), sie bewegen sich also in keine bestimmte Richtung. Deshalb sprichst du auch von einer ungerichteten Bindung.
- Die freien Elektronen verhalten sich ähnlich wie in einem Gas. Daher bezeichnest du sie auch als Elektronengas.
Durch die Anziehungskräfte zwischen den positiven Metall-Kationen und dem negativ geladenem Elektronengas kommt es zum Zusammenhalt der Metalle. Du sprichst hier also von der metallischen Bindung.
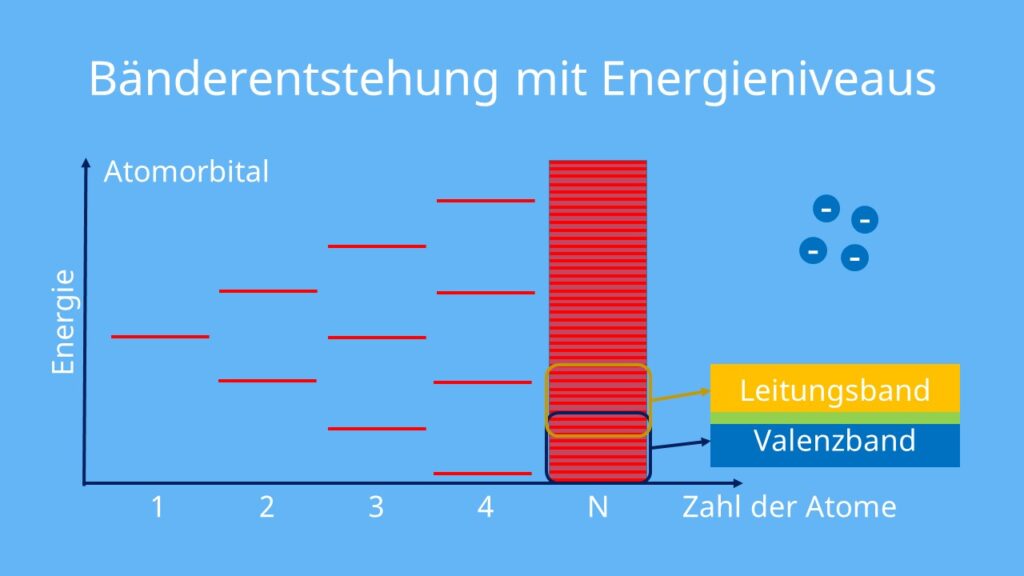
Bändermodell
Ein weiterführendes Modell zur Beschreibung der Metallbindung ist das Bändermodell. Es beruht auf dem Orbitalmodell . Mit ihm kannst du metallische Eigenschaften wie die elektrische Leitfähigkeit noch genauer erklären als beim Elektronengasmodell.
Das Bändermodell sieht folgendermaßen aus:
- Die Orbitale zweier Metall-Atome, beispielsweise von Lithium, besitzen die gleiche Energie. Sie sind also entartet.
- Beim Zusammenfügen von zwei Metall-Atomen kommt es zu einer Aufspaltung der Energieniveaus. Sogenannte Molekülorbitale entstehen. Sie besitzen nicht die gleichen Energien, sind also nicht mehr entartet.
- Je mehr Atome hinzukommen, desto dichter liegen die Energieniveaus der Molekülorbitale übereinander.
- Viele übereinanderliegende Energieniveaus bilden ein Band, da sie kaum auseinander gehalten werden können. Du nennst es Energieband.
- Das oberste Band, das noch mit den Valenzelektronen besetzt ist, nennst du Valenzband. Das Band darüber bezeichnest du als Leitungsband.
Die Elektronen sind frei beweglich, da sie freie Molekülorbitale besetzen können. Damit bilden sie die Grundlage für die Eigenschaften der Metallbindung, wie etwa die elektrische Leitfähigkeit.
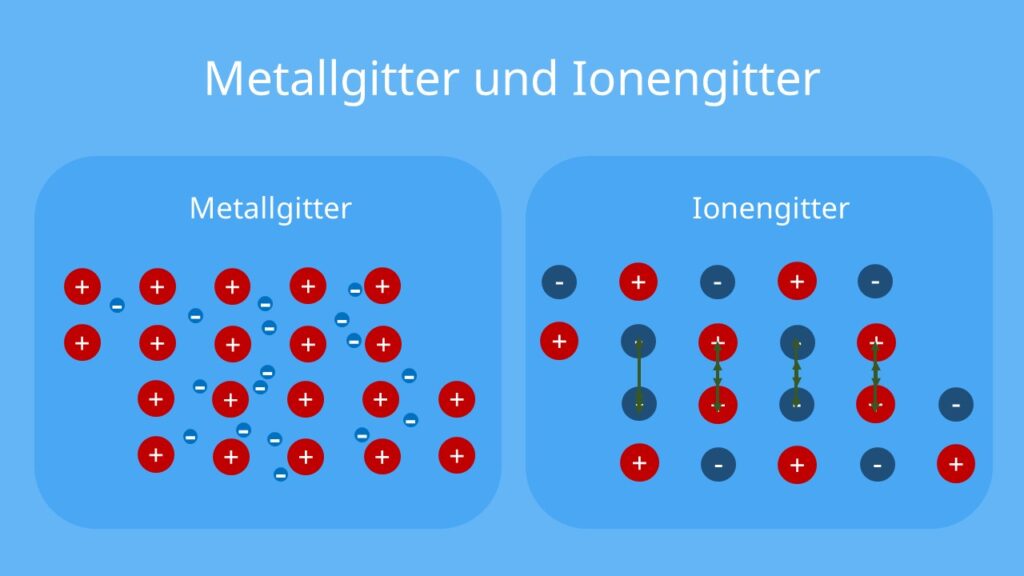
Metallgitter
Die Metall-Ionen, also die Atomrümpfe, sind regelmäßig angeordnet. Dabei entsteht das sogenannte Metallgitter. Die abgegebenen Elektronen befinden sich in den Zwischenräumen des Gitters.
Hier gibt es einige Unterschiede zum Ionengitter:
| Kategorien | Metallgitter | Ionengitter |
|
Aufbau |
Das Metallgitter ist aus Metall-Kationen und dem Elektronengas aufgebaut. |
Das Ionengitter besteht aus negativ geladenen Anionen und positiv geladenen Kationen. |
|
Verschiebung |
Beim Metallgitter bleiben bei einer Verschiebung die frei beweglichen Elektronen stets zwischen den Kationen |
Beim Verschieben des Ionengitters liegen die Kationen direkt neben anderen Kationen und die Anionen liegen direkt neben anderen Anionen. |
|
Folgen der Verschiebung |
Hier kommt es zu keiner Abstoßung und das Metallgitter bleibt weiter stabil. |
Die gleichartigen Ladungen stoßen sich deshalb gegenseitig ab und das Gitter wird gebrochen. |
Metallbindung Beispiele
Schauen wir uns die Metallbildung an zwei Beispielen an. Hierfür wirfst du am besten einen Blick auf die linke Seite im Periodensystem .
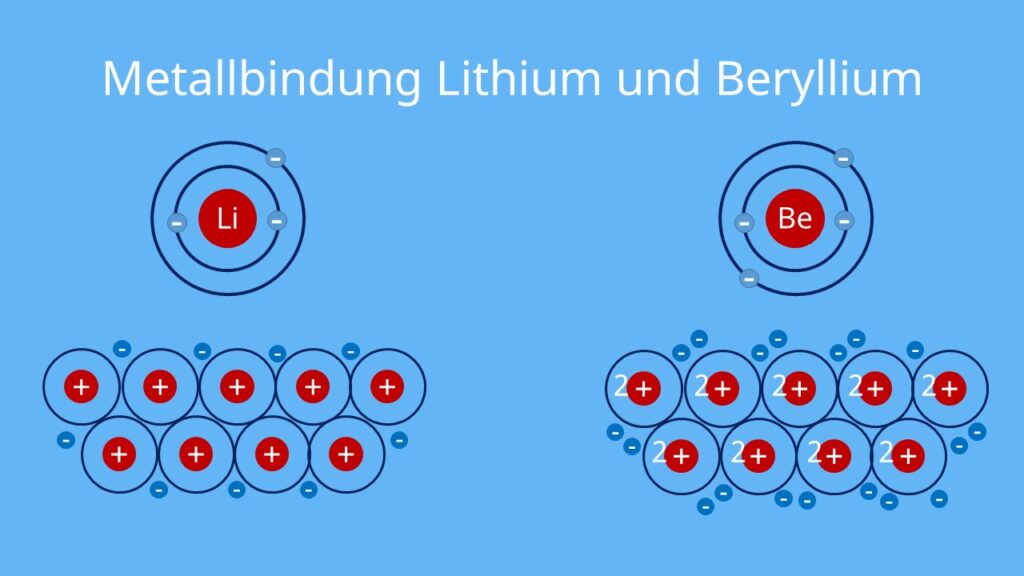
Lithium (Li):
- Das Alkalimetall Lithium befindet sich in der 1. Hauptgruppe.
- Es besitzt ein Valenzelektron auf seiner äußersten Schale, das es abgeben kann.
- Im Metall wird Lithium pro positives Li+-Ion durch ein Elektron zusammengehalten.
Beryllium (Be):
- Das Erdalkalimetall Beryllium ist in der 2. Hauptgruppe.
- Es kann zwei Valenzelektronen abgeben.
- Beryllium hat doppelt so viele Elektronen im Elektronengas wie Lithium. Dadurch werden die positiven Be2+-Ionen stärker zusammengehalten.
- Beryllium ist deshalb ein härteres Metall als Lithium.
Verformbarkeit (Duktilität)
In einem Metallgitter lassen sich die Metallatome gegeneinander verschieben, ohne dass die Bindungen sich lösen. Das macht die Metalle beim Erhitzen verformbar und schmiedbar, also duktil.
Typische Beispiele hierfür sind Gold (Au) und Silber (Ag). Aus ihnen kannst du gut Schmuck herstellen. Bei einem Ionengitter wäre das nicht möglich. Das Gitter würde durch die Abstoßungskräfte zerspringen, wie du es von Keramik kennst.
Elektrische Leitfähigkeit
Die elektrische Leitfähigkeit kannst du sowohl bei festen als auch flüssigen Metallbindungen beobachten. Sie lässt sich am besten mit dem Bändermodell erklären. Durch die Bänder können die Elektronen sich frei bewegen. Beim Anlegen einer Spannung kann dann Strom fließen. Bei der Wärmezufuhr fangen die Elektronen an zu schwingen und stoßen aneinander. Dabei geben sie die Wärme als Bewegungsenergie weiter.
Die Elektronen können in eine Richtung wandern, was dem elektrischen Strom entspricht.
Hoher Schmelzpunkt
Metalle haben in der Regel hohe Schmelzpunkte. Es herrscht nämlich eine relativ starke Bindung zwischen den Elektronen und den positiv geladenen Metall-Ionen. Deshalb benötigst du häufig höhere Temperaturen, um Metalle zu schmelzen.
Die Stärke der Metallbindung hängt von der Anzahl an Valenzelektronen ab. Alkalimetalle besitzen nur ein Valenzelektron. Sie sind verhältnismäßig weich und haben etwas niedrigere Schmelzpunkte sowie eine geringe Dichte. Metalle aus den Nebengruppen 5 und 6 wie Molybdän oder Wolfram sind besonders hart und besitzen hohe Schmelzpunkte, da sie mehr Außenelektronen haben.
Noch mehr zu Metallen, ihren Eigenschaften und ihrem Vorkommen, bekommst du in unserem extra Video . Schau unbedingt vorbei!
Metallische Bindung Vorkommen
Die metallische Bindung kommt bei den metallischen Elementen wie Eisen (Fe) oder Kupfer (Cu) vor, sowie in Mischungen von Metallen, den Legierungen.
Aber auch bestimmte Salze können metallische Eigenschaften wie den typischen metallischen Glanz oder die elektrische Leitfähigkeit haben. Dabei handelt es sich um eine Übergangsform zur Ionenbindung.
Mittlerweile haben es Forscher sogar geschafft, Kunststoffe mit metallischen Eigenschaften herzustellen. Kunststoffe sind große Moleküle, die über kovalente Bindungen zusammengehalten werden.
Bindungsarten in der Chemie
Die Metallbindung gehört neben der kovalenten Bindung und der Ionenbindung zu den starken Bindungsarten in der Chemie.
Kovalente Bindung
Bei der kovalenten Bindung oder Atombindung teilen sich die Bindungspartner ihre Elektronen. Sie bilden dabei mindestens ein Elektronenpaar aus. Das wird von beiden Atomen ‚genutzt‘, um die Edelgaskonfiguration zu erreichen. Die Atombindung ermöglicht so den Zusammenhalt zwischen den Bindungspartnern.
Ionenbindung
Die Ionenbindung entsteht in der Regel zwischen einem Metall und einem Nichtmetall bei einer Elektronegativitätsdifferenz über 1,7. Dabei überträgt ein Metall seine Valenzelektronen auf ein Nichtmetall. Dadurch entstehen elektrisch geladene Teilchen, die Ionen .
Zwischen den positiv und negativ geladenen Ionen herrschen elektrostatische Anziehungskräfte. Bei der metallischen Bindung erfolgt der Zusammenhalt hingegen durch Anziehungskräfte zwischen Metall-Kationen und negativ geladenen Elektronen.
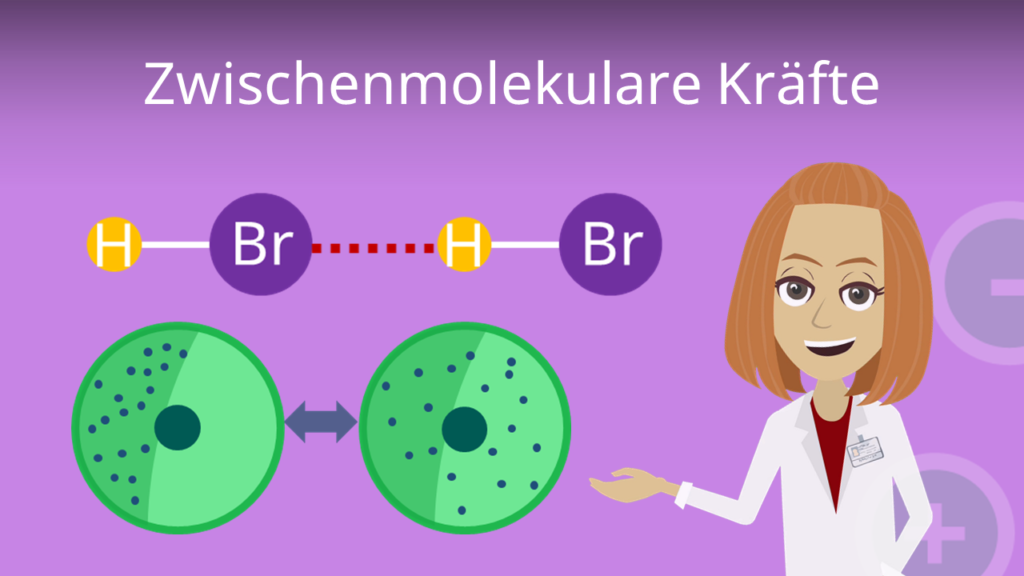
Zwischenmolekularen Wechselwirkungen
Außerdem gibt es Kräfte zwischen Molekülen, die sogenannten zwischenmolekularen Wechselwirkungen. Sie sind schwächer als die ‚klassischen‘ Bindungsarten. Hierzu zählst du zum Beispiel folgende:
- Wasserstoffbrückenbindungen sind Wechselwirkungen zwischen partiell positiv geladenen Wasserstoffatomen und partiell negativ geladenen Atomen aus anderen Molekülen.
- Van-der-Waals-Kräfte sind Anziehungskräfte zwischen Dipolen, die durch unsymmetrische Ladungsverteilungen in unpolaren Molekülen entstehen.
Mehr zu den zwischenmolekularen Kräften, erfährst du in unserem extra Video dazu. Schau vorbei!