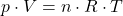Avogadro Konstante
Was bedeutet die Avogadro Konstante für einen Stoff und wie lässt sich diese bestimmen? Wir geben dir in diesem Artikel die Antworten auf diese Fragen und erklären dir, was den sogenannten Satz von Avogadro ausmacht.
Du willst den Inhalt dieses Artikels in visueller Form sehen? Dann ist unser Video dazu die perfekte Lösung für dich.
Inhaltsübersicht
Avogadro Konstante einfach erklärt
Die Avogadro Konstante (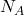 ) ist eine wichtige physikalische Konstante, die für dich in verschiedensten Zusammenhängen nützlich ist. Sie wurde nach dem italienischen Physiker Amadeo Avogadro benannt und wird auch oft als avogadrosche Konstante bezeichnet.
) ist eine wichtige physikalische Konstante, die für dich in verschiedensten Zusammenhängen nützlich ist. Sie wurde nach dem italienischen Physiker Amadeo Avogadro benannt und wird auch oft als avogadrosche Konstante bezeichnet.
Merke: Die Avogadro Konstante gibt dir an, wie viele Teilchen (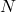 ) in einem Mol, der Einheit der Stoffmenge (
) in einem Mol, der Einheit der Stoffmenge (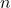 ), enthalten sind.
), enthalten sind.
Der Artikel Molare Masse berechnen geht auf den Zusammenhang zwischen dem Mol und der Masse eines Stoffes ein.
Als Formel ausgedrückt kannst du dir merken:
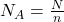
Die Avogadro Konstante ist exakt auf 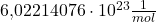 festgelegt. Die Zahl
festgelegt. Die Zahl 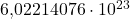 kannst du auch als Avogadro Zahl bezeichnen.
kannst du auch als Avogadro Zahl bezeichnen.
Bestimmung der Avogadro Konstante
Du kannst die Avogadro Zahl durch verschiedenste Methoden bestimmen oder berechnen.
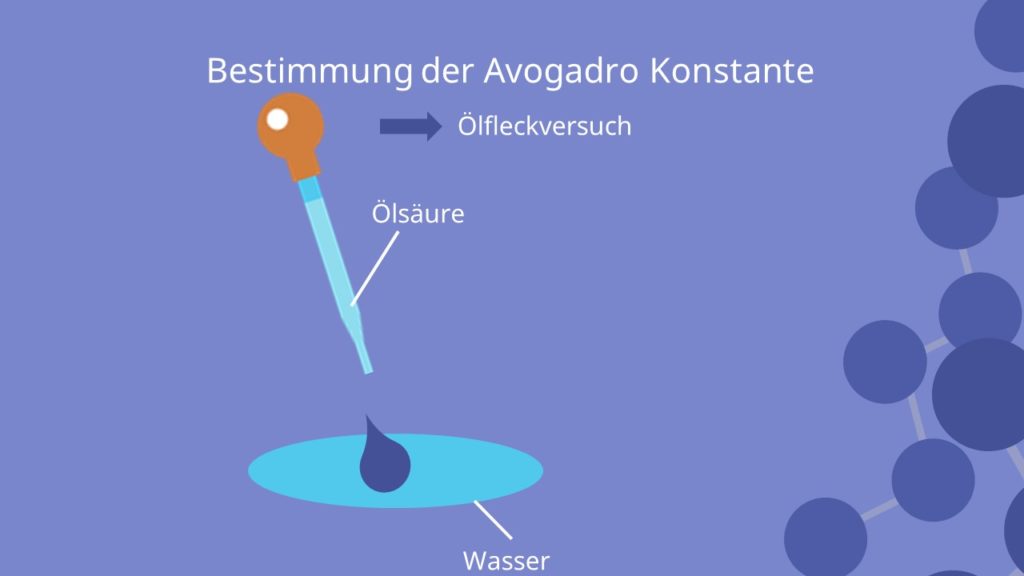
Eine Methode ist der sogenannte „Ölfleckversuch„. Hierbei gibst du einen Tropfen Ölsäure auf Wasser. Dieser breitet sich über die gesamte Oberfläche aus und bildet einen „Film„. Dadurch, dass sich die Schicht über das gesamte Wasser ausdehnt, kannst du annehmen, dass die Dicke der Schicht ca. dem Durchmesser 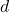 eines Ölsäuremoleküls entspricht.
eines Ölsäuremoleküls entspricht.
Nun nimmst du an, dass das Ölsäuremolekül ein Volumen (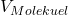 ) von
) von 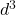 einnimmt. Wenn du das Volumen des gesamten Öls durch das Volumen eines Ölsäuremoleküls teilst, kannst du die Molekülzahl in einem Mol des Ölflecks berechnen. Diese Anzahl an Molekülen ist deine Avogadro Zahl:
einnimmt. Wenn du das Volumen des gesamten Öls durch das Volumen eines Ölsäuremoleküls teilst, kannst du die Molekülzahl in einem Mol des Ölflecks berechnen. Diese Anzahl an Molekülen ist deine Avogadro Zahl:
![Rendered by QuickLaTeX.com N_A=\frac {V_{mol} [\frac {cm^3}{mol}]} {V_{Molekuel} [cm]}](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-b25c2d4e4ec294d9c03f989fe7d459be_l3.png)
Das Ergebnis der Avogadro Zahl liegt meist im Bereich von ca. 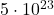 bis
bis 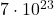 , also nahe beim wirklichen Wert von
, also nahe beim wirklichen Wert von 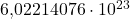 .
.
Eine weitere Methode wäre die Bestimmung der Avogadro Konstanten durch Elektrolyse im Hofmannschen Zersetzungsapparat
. Hierbei ist die Ladung, die durch den Elektrolyten fließt, ein direktes Maß für die abgeschiedene Stoffmenge  , also auch für die Anzahl der abgeschiedenen Teilchen. Wenn du diese Anzahl auf ein Mol umrechnest, erhältst du daraus deine Avogadro Konstante.
, also auch für die Anzahl der abgeschiedenen Teilchen. Wenn du diese Anzahl auf ein Mol umrechnest, erhältst du daraus deine Avogadro Konstante.
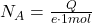
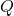 steht hier für die Ladung und
steht hier für die Ladung und  für die Elementarladung.
für die Elementarladung.
Anwendung der Avogadro Konstante
Die Avogadro Konstante wird in den verschiedensten Zusammenhängen angewendet. So kannst du zum Beispiel die Formel umstellen, um die Stoffmenge eines bestimmten Materials zu bestimmen.
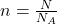
Aus dieser Stoffmenge 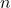 kannst du unter anderem die Stoffmengenkonzentration
berechnen.
kannst du unter anderem die Stoffmengenkonzentration
berechnen.
Du kannst die Avogadro Konstante nicht nur bei rein chemischen Themen anwenden, sondern auch in der Elektrochemie.
Sie wird beispielsweise im Zusammenhang mit dem Faraday Gesetz und der Nernst Gleichung verwendet.
Satz von Avogadro
Der Satz von Avogadro wird auch Avogadro Gesetz oder Avogadrosches Gesetz genannt. Mit diesem Gesetz wird beschrieben, dass in gleichen Volumen, bei gleicher Temperatur und bei gleichem Druck alle Gase die selbe Anzahl an Molekülen enthalten. Dabei muss die gegenseitige Entfernung der Moleküle so groß sein, dass deren Wechselwirkungen vernachlässigbar sind. In diesem Fall spricht man von einem idealen Gas.
Amadeo Avogadro leitete diesen Satz aus den Gesetzen von Gay Lussac (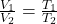 ) und Boyle Mariotte (
) und Boyle Mariotte (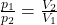 ) her.
) her.
Das Avogadro Gesetz lautet :
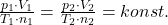
Dieser Zusammenhang bedeutet, dass die Konstante für alle idealen Gase den selben Wert annimmt. Aus diesem Grund wird dieser konstante Wert auch als universelle oder allgemeine Gaskonstante bezeichnet. Aus der Gaskonstante kannst du die sogenannte Gasgleichung herleiten: