Molare Masse berechnen
Was ist die molare Masse, wie lautet ihre Formel und wie kannst du sie berechnen? Das alles erklären wir dir genau hier oder direkt in unserem Video !
Inhaltsübersicht
Molare Masse berechnen einfach erklärt
Die molare Masse ist die Masse m eines Stoffes geteilt durch seine Stoffmenge n. Das Formelzeichen der molaren Masse ist ein M. Du gibst sie in der Einheit Gramm pro Mol oder Kilogramm pro Mol an (g/mol bzw. kg/mol).
![Rendered by QuickLaTeX.com \[\textcolor{red}{M} = \frac{\textcolor{blue}{m}}{\textcolor{orange}{n}}\]](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-f4efb664710e8a672a36d10b4f24164a_l3.png)
Mit der molaren Masse beschreibst du, wie schwer ein Mol eines Stoffes ist. Mol ist die Einheit der Stoffmenge und gibt an, wie viele Teilchen in einem Stoff vorhanden sind. In einem Mol sind das immer 6,022 · 1023 Teilchen. Die Teilchenzahl hat damit den gleichen Zahlenwert wie die Avogadro-Konstante (NA).
Achtung: Die Molare Masse ist keine Masse, sondern eine Stoffkonstante. Deshalb solltest du auch den veralteten Begriff ‚Molmasse‘ vermeiden.
In der Chemie berechnet man die molare Masse M eines Moleküls, indem man die molaren Massen der jeweiligen Elemente mit ihren Indexzahlen multipliziert und sie schließlich addiert (z.B. MH20 = 2 • MH + 1 • MO).
Molare Masse Formel
Die Formel der molaren Masse M lautet:

Die molare Masse M ist die Masse m geteilt durch die Stoffmenge n. Das ist das gleiche wie die Avogadro-Konstante NA mal die Molekülmasse mM.
- M = Molare Masse in g/mol
- m = Masse in g
- n = Stoffmenge in mol
-
NA= Avogadro-Konstante in mol-1
- mM = Molekülmasse in g
Du kannst die molare Masse also einerseits als Verhältnis von Masse (m) zur Stoffmenge (n) beschreiben. Andererseits kannst du sie auch mithilfe der Avogadro-Konstanten (NA) und der Molekülmasse (mM) berechnen.
Außerdem kannst du die Formel der molaren Masse auch umstellen, um so die Stoffmenge n zu berechnen. Für die Stoffmenge schreibst du:
n = m/M
Du kannst also die Stoffmenge n durch das Verhältnis aus der Masse m und der molaren Masse M berechnen. Um die Masse m zu berechnen, nutzt du die Formel:
m = M • n
Also Masse m ist gleich molare Masse M mal Stoffmenge n.
Merke: Da du beim Berechnen der molaren Masse in der Chemie oft mit sehr kleinen Mengen arbeitest, gibst du die molare Masse in der Regel mit der Einheit Gramm pro Mol (g/mol) statt in Kilogramm pro Mol (kg/mol) an.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Molare Masse berechnen: Schritt für Schritt
Die Berechnung der molaren Masse kannst du dir in drei Schritte unterteilen:
Schritt 1: Entnehme zunächst für jedes Element deiner Summenformel die sogenannte Indexzahl. Du findest sie direkt hinter dem jeweiligen Elementsymbol.
- Beispiel: Wasser H2O: Für das Element H (Wasserstoff) lautet sie 2 und für das Element O (Sauerstoff) 1.
Schritt 2: Suche dir jetzt aus Tabellen, wie zum Beispiel deinem Periodensystem, den Zahlenwert der molaren Masse für jedes Element heraus.
-
Beispiel: Wasser H2O
- Molare Masse Wasserstoff: MH = 1,008 g/mol
- Molare Masse Sauerstoff: MO = 15,999 g/mol
Schritt 3: Jetzt kannst du die molare Masse der Verbindung berechnen, indem du die molaren Massen der Elemente addierst. Hier musst du darauf achten, dass du die Elemente mit ihren Indexzahlen multiplizierst.
- Beispiel: Wasser H2O
MWasser = 2 MH + 1 MO = 2 · 1,008 g/mol + 15,999 g/mol = 18,015 g/mol
Die molare Masse von Wasser beträgt also ungefähr 18 Gramm pro Mol.
Merke: Die molare Masse M einer Verbindung ist die Summe der molaren Massen der Elemente, aus denen sie besteht, multipliziert mit ihren Indexzahlen.
Molare Masse im Periodensystem
Die molare Masse eines Atoms kannst du in deinem Periodensystem ganz einfach ablesen. Du findest sie rechts neben dem Elementsymbol.
Bei Sauerstoff kannst du zum Beispiel die molare Masse von 15,999 ablesen.
Tatsächlich gibt die Zahl die Atommasse in der atomaren Masseneinheit u an. Sie ist als ein Zwölftel der Masse des Kohlenstoff-Isotops 12C definiert. Für dich ist das aber kein Problem, weil die Atommasse den gleichen Wert wie die molare Masse M hat.
Tipp: Nutze für die Berechnung der molaren Masse einfach dein Periodensystem. Lies dann die Atommassen der Elemente ab.
Molare Masse chemischer Elemente und Verbindungen
Du kannst die jeweilige molare Masse chemischer Elemente ganz einfach aus dem Periodensystem entnehmen. Hier sind ein paar Beispiele für Elemente und Verbindungen zusammengestellt.
Beachte: Die molaren Massen sind hier jeweils auf- bzw. abgerundet.
| Elemente/Verbindung | Symbol/Summenformel | molare Masse [g/mol] |
| molare Masse Wasserstoff | H | 1 |
| molare Masse Kohlenstoff | C | 12 |
| molare Masse Stickstoff | N | 14 |
| molare Masse Sauerstoff | O | 16 |
| molare Masse Wasser | H2O | 18 |
| molare Masse Kohlenstoffdioxid | CO2 | 44 |
| molare Masse Salz | NaCl | 58,4 |
| molare Masse Ethanol | C2H5OH | 46,07 |
Beispiel 1
Aufgabe: 0,4 mol eines Stoffes wiegen 130g. Wie groß ist seine molare Masse?
Zur Erinnerung: Die Formel, um die molare Masse berechnen zu können, lautet:
M = m / n
Lösung: Setze nun die gegebenen Werte für die Masse und die Stoffmenge in die Gleichung ein.
M = 130 g / 0,4 mol = 325 g/mol
Die molare Masse des Stoffs beträgt also 325 g/mol.
Beispiel 2
Aufgabe: Ein Molekül hat die molare Masse von 180 g/mol. Handelt es sich dabei um Benzoylperoxid(C14H10O4) oder um Acetylsalicylsäure(C9H8O4)?
Wie groß ist die Stoffmenge in 2 kg der Verbindung?
Lösung: Beide Verbindungen enthalten die gleichen Elemente. Deshalb kannst du dir diese schon einmal heraussuchen und die molaren Massen aufschreiben.
C = 12 g/mol
H = 1 g/mol
O = 16 g/mol
Jetzt kannst du für deine beiden Verbindungen die molare Masse berechnen:
- Für Benzoylperoxid bekommst du eine molare Masse von M = 242 g/mol.
- Für Acetylsalicylsäure lautet die molare Masse M = 180 g/mol.
⇒ Deine gesuchte Verbindung ist also Acetylsalicylsäure.
Gehen wir nun den zweiten Teil an: Hier sollst du die Stoffmenge der eben bestimmten Verbindung berechnen.
- Stelle dafür die Formel nach der Stoffmenge um. Das gelingt dir, indem du jeweils mit n multiplizierst und durch M teilst.
n = m / M
- Da du alle Werte gegeben hast, kannst du sie einfach einsetzen. Vergiss aber nicht, auf die Einheiten zu achten.
n = 2000 g / 180 g/mol = 11,1 mol
2 kg Acetylsalicylsäure enthält also 11,1 mol.
Expertenwissen: Mittlere Molare Masse Luft
Einen Spezialfall stellt die Luft dar. Da diese ein Gasgemisch ist, kannst du die molare Masse nicht ohne weiteres bestimmen. Um dennoch ein Ergebnis zu erhalten, wird in so einem Fall die molare Masse über die mittlere molare Masse bestimmt.
Dabei integrierst du den Stoffmengenanteil des jeweiligen Elements oder Moleküls in die Berechnung mit ein. Für die mittlere molare Masse Luft musst du also die Zusammensetzung der Luft kennen.
Die Luft besteht aus:
- den beiden Hauptkomponenten Stickstoff N2 (M=28 g/mol) und Sauerstoff O2 (M=32 g/mol),
- daneben vor allem aus Argon Ar (M=39,9g/mol) und Kohlendioxid CO2 (M=44 g/mol).
Beachte: Den Wasseranteil in Form von Wasserdampf können wir bei trockener Luft vernachlässigen.
Damit ergibt sich folgende Zusammensetzung der Luft auf Meereshöhe:
- N2 ca. 78,08%
- O2 ca. 20,94%,
- Ar ca. 0,93%,
- CO2 ca. 0,04%
Für die molare Masse der Luft gilt somit folgende Berechnung:


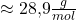
Die mittlere molare Masse der Luft beträgt also:
 .
.
Molare Masse berechnen — häufigste Fragen
(ausklappen)
Molare Masse berechnen — häufigste Fragen
(ausklappen)-
Wie erkenne ich bei Klammern in der Summenformel, welche Indexzahlen ich wirklich multiplizieren muss?Du multiplizierst die Atommassen zuerst mit der Indexzahl direkt am Element und danach mit der Zahl hinter der Klammer. Das liegt daran, dass die Klammer die ganze Gruppe mehrfach „nimmt“. Beispiel: In
 gilt
gilt  zweimal und
zweimal und  zweimal, also
zweimal, also  .
.
-
Was ist der Unterschied zwischen molarer Masse und Molekülmasse in u?Die molare Masse ist „Gramm pro Mol“, die Molekülmasse ist „u pro Teilchen“. Beide haben denselben Zahlenwert, aber unterschiedliche Bedeutung und Einheit. Das liegt daran, dass 1 u so definiert ist, dass 1 Mol dieser Teilchen genau diese Zahl in Gramm wiegt. Beispiel:
 hat 18 u und 18 g/mol.
hat 18 u und 18 g/mol.
-
Welche typischen Einheiten-Fehler passieren bei
 am häufigsten?
Am häufigsten werden g und kg gemischt, sodass
am häufigsten?
Am häufigsten werden g und kg gemischt, sodass und
und  nicht zusammenpassen. Deshalb musst du immer dafür sorgen, dass
nicht zusammenpassen. Deshalb musst du immer dafür sorgen, dass  in g steht, wenn
in g steht, wenn  in g/mol gegeben ist. Beispiel: 2 kg sind 2000 g, sonst bekommst du
in g/mol gegeben ist. Beispiel: 2 kg sind 2000 g, sonst bekommst du  um den Faktor 1000 falsch.
um den Faktor 1000 falsch.
-
Wie berechne ich die molare Masse von Ionenverbindungen, wenn es keine „Moleküle“ gibt?Du berechnest die molare Masse trotzdem aus der Formeleinheit, also aus dem kleinsten Zahlenverhältnis der Ionen in der Summenformel. Das funktioniert, weil auch Ionenkristalle eine feste Zusammensetzung pro Formeleinheit haben. Beispiel: Für
 gilt
gilt  .
.
-
Wie rechne ich mit der molaren Masse eine Stoffmengenkonzentration in mol/L aus?Du nutzt
 und ersetzt
und ersetzt  durch
durch  , also
, also  . Das verbindet Masse, Volumen und molare Masse in einem Schritt. Beispiel: 5,85 g NaCl in 0,50 L:
. Das verbindet Masse, Volumen und molare Masse in einem Schritt. Beispiel: 5,85 g NaCl in 0,50 L:  mol/L.
mol/L.
Stoffmengenkonzentration
Die molare Masse kann dir dabei helfen, die Stoffmengenkonzentration c herauszufinden! Sie gibt an, was für ein Anteil ein bestimmter Stoff in einer Stoffmischung hat. Wenn du noch mehr über die Stoffmengenkonzentration wissen möchtest, dann schau dir dazu unser Video an!