Pauli Prinzip
In diesem Beitrag erklären wir dir, was das sogenannte Pauli Prinzip ist und welche Konsequenzen sich aus diesem ergeben.
Du willst den Inhalt dieses Beitrags noch schneller verstehen? Dann schau dir gerne unser Video zum Pauli Prinzip an.
Inhaltsübersicht
Pauli Prinzip einfach erklärt
Das Pauli Prinzip ist eine Regel im Bereich der Quantenmechanik, die nach seinem Entdecker Wolfgang Pauli benannt wurde. Du kannst das Pauli Prinzip als Pauli Verbot, paulisches Ausschlussprinzip oder Pauli Regel bezeichnen.
Das Pauliprinzip bezieht sich auf die Teilchen in einem Atom. Diese Teilchen (z.B. Elektronen) bewegen sich nach dem Orbitalmodell in dreidimensionalen Räumen um den Atomkern (= Orbitale). Wenn sich diese Orbitale überlappen, können sich mehrere Elektronen im selben Bereich aufhalten.
Das Pauliprinzip besagt, dass zwei Elektronen in einem Atom nicht in allen Quantenzahlen übereinstimmen können. Unter einer Quantenzahl kannst du dir einen Wert vorstellen, der die Bewegungseigenschaften des Elektrons angibt.
Es existieren vier Quantenzahlen .
- Hauptquantenzahl
 : Gibt an, in welcher Schale sich das Elektron befindet
: Gibt an, in welcher Schale sich das Elektron befindet - Nebenquantenzahl
 : Gibt an, welche Form das Orbital hat.
: Gibt an, welche Form das Orbital hat. - Magnetische Drehimpulszahl
 : Gibt an, wie der Elektronen-Bahndrehimpuls räumlich orientiert ist.
: Gibt an, wie der Elektronen-Bahndrehimpuls räumlich orientiert ist. - Magnetische Spinquantenzahl
 : Gibt an, welche Orientierung ein Spin zur z-Achse hat.
: Gibt an, welche Orientierung ein Spin zur z-Achse hat.
Nach dem Pauli Prinzip müssen sich also zwei Elektronen in mindestens einer dieser Zahlen unterscheiden.
Das Pauli Prinzip (eng.: pauli principle, pauli exclusion principle) ist eine Regel aus der Quantenphysik. Sie besagt, dass die Gesamtwellenfunktion eines Systems von Fermionen antisymmetrisch sein muss.
Allgemeine Form
Grundsätzlich gilt das Pauliprinzip für alle Elementarteilchen
mit einem halbzahligen Spin ( ). Diese kannst du auch als Fermionen bezeichnen. Zu ihnen gehören zum Beispiel Protonen, Neutronen oder Elektronen.
). Diese kannst du auch als Fermionen bezeichnen. Zu ihnen gehören zum Beispiel Protonen, Neutronen oder Elektronen.
Elementarteilchen mit einem ganzzahligen Spin werden dagegen Bosonen genannt. Diese unterliegen nicht dem Pauli Prinzip.
Um das Pauli Prinzip allgemein in einer Formel zu beschreiben, benötigst du die sogenannte Gesamtwellenfunktion ( ). Diese setzt sich in einigen Fällen aus der Ortsraum-Wellenfunktion (
). Diese setzt sich in einigen Fällen aus der Ortsraum-Wellenfunktion ( ) und der Spinwellenfunktion (
) und der Spinwellenfunktion ( ) zusammen.
) zusammen.
Allgemein kannst du sie aber für  Fermionen so formulieren:
Fermionen so formulieren:
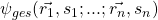
 steht für den Ort und
steht für den Ort und  für den Spin des
für den Spin des  -ten Fermions.
-ten Fermions.
Nun musst du diese allgemeine Form mit einer Form gleichsetzen, die jede Vertauschung zweier Teilchen miteinbezieht. Diese Vertauschung kannst du durch den sogenannten Permutationsoperator ( ) darstellen. Seine Aufgabe ist es, die Indizes von zwei Teilchen untereinander zu tauschen:
) darstellen. Seine Aufgabe ist es, die Indizes von zwei Teilchen untereinander zu tauschen:

Das allgemeine Pauli-Prinzip sieht dann so aus:

Das  hinter dem Gleichheitszeichen stellt die antisymmetrische Bedingung dar.
hinter dem Gleichheitszeichen stellt die antisymmetrische Bedingung dar.
Wenn du nun zwei nicht unterscheidbare Fermionen betrachtest, erhältst du:

Da hier das Vorzeichen der beiden Funktionen unterschiedlich ist, ist die Wahrscheinlichkeit, dass sich beide Fermionen am selben Ort ( ) mit demselben Spin (
) mit demselben Spin ( ) befinden, gleich null.
) befinden, gleich null.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Pauli Prinzip Hundsche Regel
Das Pauli Prinzip steht in einem engen Zusammenhang mit den sogenannten Hundschen Regeln . Diese geben eine Aussage darüber, in welcher Drehimpulskonfiguration Elektronen in den Orbitalen eines Atoms vorliegen.
Das Pauli Prinzip gibt dabei die Grundlage dafür, wie die einzelnen Schalen eines Atoms aufgefüllt werden. So gibt sie beispielweise an, dass in einem Orbital maximal zwei Elektronen liegen können. Außerdem müssen beide Elektronen innerhalb des Orbitals verschiedene Spinrichtungen besitzen.
Konsequenzen
Aus dem Pauliprinzip ergeben sich neben der Bedeutung für die Hundschen Regeln weitere Konsequenzen.
Da sich in jedem Orbital nur maximal zwei Elektronen befinden können, besitzen Atome mit mehr Elektronen auch mehr Orbitale. Je mehr Orbitale ein Atom in sich trägt, desto größer ist es.
Außerdem kannst du in Kombination mit den Hundschen Regeln die Elektronenkonfiguration jedes beliebigen Atoms beschreiben. Die Verteilung der Elektronen auf die unterschiedlichen Orbitale stellt dabei die Grundlage für den Aufbau des Periodensystems dar.
Ein weiterer wichtiger Anwendungsfall für das Pauli Prinzip ist in der Astronomie. Hier erzeugen alte Sterne wie z.B. sogenannte weiße Zwerge oder Neurosterne eine sehr hohe Gravitation. Damit diese Sterne nicht zusammenbrechen, erzeugen die antisymmetrischen Fermionen einen Gegendruck.
