Alkine
Aliphatische Kohlenstoffe mit Dreifachbindungen heißen Alkine. In diesem Artikel lernst du neben den Unterschieden zu Alkanen und Alkenen auch die Nomenklatur, ihre Eigenschaften und einige Reaktionen kennen.
In unserem Video zum Thema Alkine kannst du dir all das in kurzer Zeit entspannt erklären lassen.
Inhaltsübersicht
Alkine einfach erklärt
Alkine sind neben den Alkenen aliphatische und ungesättigte Kohlenwasserstoffe . Ethin ist das einfachste Alkin und damit das erste aus der homologen Reihe. Die typischen Reaktionen sind vor allem Additionsreaktionen. Eine Besonderheit stellt die CH-Acidität dar im Vergleich zu den Alkanen und Alkenen. Alkine lassen sich außerdem durch eine allgemeine Summenformel darstellen, wobei sie 2 Wasserstoffatome weniger besitzen als die entsprechenden Alkene und 4 weniger als die jeweiligen Alkane.
Alkine sind aliphatische Kohlenwasserstoffe mit mindestens einer Dreifachbindung.
Alkane Alkene Alkine
Alkane, Alkene und Alkine gehören zu den aliphatischen Kohlenwasserstoffen. Dabei sind Alkene mit ihren Doppelbindungen und Alkine mit den Dreifachbindungen ungesättigte und Alkane gesättigte Kohlenwasserstoffe. Durch eine Doppelbindung besitzen Alkene bereits 2 Wasserstoffatome weniger als die Alkane und die Alkine sogar nochmal 2 weniger, da sie mindestens eine Dreifachbindung zwischen zwei Kohlenstoffatomen vorweisen. Die Summenformel für Alkane lautet CnH2n+2, Alkene haben also die Summenformel CnH2n und ein Alkin somit CnH2n-2.
Die allgemeine Summenformel der Alkine lautet: CnH2n-2
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Nomenklatur Alkine
Alkine kannst du benennen, indem du den Alkan-Stammnamen nimmst und das -an am Ende durch -in ersetzt. Dreifachbindungen gelten ebenso wie Doppelbindungen als funktionelle Gruppen , wobei die Dreifachbindung eine höhere Priorität hat als die Doppelbindung. Mit einer möglichst kleinen Ziffer gibst du noch an, zwischen welchen Kohlenstoffatomen sich die Dreifachbindung befindet. Bei mehreren Dreifachbindungen gibst du davor noch die entsprechende griechische Zahl an (-di-, -tri-, usw.). Kohlenstoffatome können nur 4 Bindungen eingehen, weshalb keine kumulierten Dreifachbindungen möglich sind, sehr wohl aber konjugierte, also immer im Wechsel mit Einfachbindungen.
Homologe Reihe der Alkine
Genauso wie für die Alkane und Alkene gibt es für unverzweigte Alkine mit der Dreifachbindung am ersten Kohlenstoffatom eine homologe Reihe:
| Name | IUPAC | Summenformel | vereinfachte Strukturformel |
| Acetylen | Ethin | C2H2 | HC≡CH |
| Methylacetylen | Propin | C3H4 | HC≡C-CH3 |
| 1-Butin | But-1-in | C4H6 | HC≡C-CH2-CH3 |
| 1-Pentin | Pent-1-in | C5H8 | HC≡C-CH2-CH2-CH3 |
| 1-Hexin | Hex-1-in | C6H10 | HC≡C-CH2-CH2-CH2-CH3 |
| 1-Heptin | Hept-1-in | C7H12 | HC≡C-CH2-CH2-CH2-CH2-CH3 |
| 1-Octin | Oct-1-in | C8H14 | HC≡C-CH2-CH2-CH2-CH2-CH2-CH3 |
| 1-Nonin | Non-1-in | C9H16 | HC≡C-CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
| 1-Decin | Dec-1-in | C10H18 | HC≡C-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 |
Alkine Eigenschaften
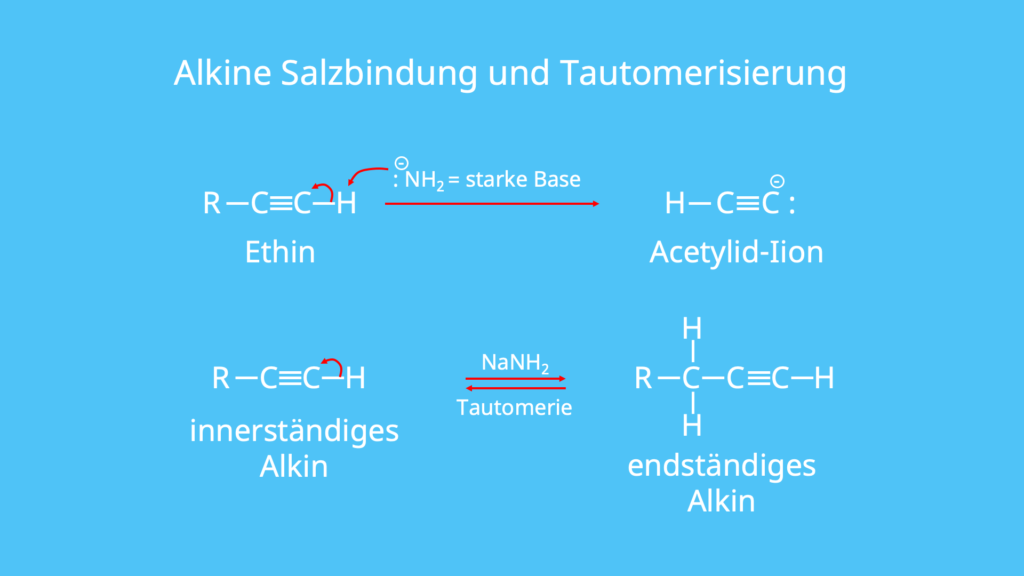
Ein Alkin besitzt mindestens eine Dreifachbindung, welche zwei Kohlenstoffatome miteinander verknüpft. Dabei handelt es sich um eine sp-Hybridisierung , welche einen erhöhten s-Orbital -Anteil vorweist. Damit haben die Elektronen eine erhöhte Aufenthaltswahrscheinlichkeit dicht am Kohlenstoffatom, also höher als bei Alkanen oder Alkenen. Terminale Alkine, das heißt solche mit der Dreifachbindung am Ende der Kette, besitzen einen niedrigeren pKS-Wert und dadurch eine höhere CH-Acidität.
Durch diesen schwach sauren Charakter kann durch starke Basen wie zum Beispiel Amid-Ionen aus Natriumamid NaNH2 das Wasserstoffatom H abgespalten werden. Durch diese Abspaltung können dann die entsprechenden Salze entstehen, die auch den Namen Acetylide tragen. Weiterhin kann durch Tautomerisierung und Addition eines Protons die Dreifachbindung innerhalb des Alkins verschoben werden. Es entstehen also Konstitutionsisomere .
Die Alkine Ethin, Propin und But-1-in sind unter Normalbedingungen Gase , während es sich ab But-2-in um Flüssigkeiten handelt. Ein Alkin ist durch seine Kohlenstoff- und Wasserstoffatom brennbar, wobei Kohlenstoffdioxid CO2 und Wasser H2O entstehen. Dadurch werden Alkine häufig zum Schweißen verwendet. In Wasser sind die ungesättigten Kohlenwasserstoffe allerdings nicht löslich, da es sich um unpolare Moleküle handelt. Die Siedetemperatur steigt innerhalb der homologen Reihe an. Insgesamt sind interne Alkine, also solche, die die Dreifachbindung mitten in der Kette aufweisen, stabiler als terminale mit der Dreifachbindung am Ende der Kette.
Ethin
Das einfachste Alkin ist Ethin, welches auch unter dem Namen Acetylen bekannt ist. Insgesamt hat dieses Molekül eine lineare Struktur durch die Dreifachbindung zwischen den beiden Kohlenstoffatomen. Ethin ist ein farbloses Gas und relativ instabil, wodurch es sehr reaktiv ist und bei Erhitzen oder durch einen Stoß explodieren kann. Diese Eigenschaften macht man sich jedoch zunutze, indem es als Schweißgas bei bis zu 3000 °C verwendet wird.
Alkine Reaktionen
Genauso wie die Alkene sind auch Alkine reaktive Verbindungen. Die Dreifachbindung bietet ein gutes Ziel für Additionsreaktionen. Bei den meisten handelt es sich um elektrophile Additionen , aber auch nucleophile Additionen sind möglich. Eine besondere Additionsreaktion ist die Polymerisation .
Additionsreaktionen
Eine typische Additionsreaktion ist die Hydrierung, bei der zwei Wasserstoffatome addiert werden. Dabei wird ein Katalysator benötigt. Im ersten Schritt wird aus dem Alkin ein Alken gebildet, welches weiter hydriert werden kann zum Alkan. Um diese zweite Hydrierung zu verhindern kannst du den Lindlar-Katalysator verwenden. Dabei dient Palladium als Katalysator und Calciumcarbonat ist der Trägerstoff. Bleiacetat oder Blei(II)-oxid fungiert als Katalysatorgift und verhindert die weitere Hydrierung des Alkens.
Bei der Hydratisierung (Reaktion mit Wasser) und unter Quecksilber-Katalyse kann ein Alkin zum Enol reagieren, wobei durch Tautomerie das bevorzugte Keton gebildet wird.
Weiterhin zeigt ein Alkin noch die Halogenierung und die Hydrohalogenierung. Bei der Hydrohalogenierung (Addition von Halogenwasserstoffen) wird die Dreifachbindung elektrophil angegriffen, wobei ein Alkenyl-Kation entsteht und schließlich ein Alken mit einem Halogen und einem Wasserstoffatom mehr. Auch bei der Halogenaddition handelt es sich um eine elektrophile Addition. Bei beiden Reaktionen wird häufig anschließend an das gebildete Alken erneut ein Halogenwasserstoff beziehungsweise Halogen addiert, was auf die höhere Reaktivität der Doppelbindung gegenüber der Dreifachbindung zurückzuführen ist.
Unter extremen Bedingungen kann es neben der elektrophilen Addition auch zur nucleophilen Addition an einem Alkin kommen. Dabei kann das Alkin mit Alkoholen zu Aldehyden /Ketonen oder mit Thiolen zu Thioenolethern reagieren.
Nicht nur Alkene, sondern auch ein Alkin kannst du für die Polymerisation verwenden. Dabei entstehen Polymere mit Doppelbindungen. Ethin kann mit Salzsäure HCl zu Vinylchlorid und mit Cyanwasserstoff HCN zu Acrylnitril reagieren. Durch Polymerisation dieser Zwischenprodukte entstehen dann Acrylfasern.
Alkine Nachweis
Die Dreifachbindung lässt sich durch die Bromwasser-Probe nachweisen. An die Dreifachbindung lagern sich Bromatome an und das braune Bromwasser verliert seine Farbe. Du solltest jedoch beachten, dass es sich hierbei um einen Nachweis für Mehrfachbindungen allgemein handelt und nicht um einen spezifischen Nachweis für Alkine.