Isomere
Was sind Isomere und welche verschiedenen Isomeriearten gibt es? In diesem Beitrag und im Video erklären wir dir alles, was du zur Isomerie wissen musst!
Inhaltsübersicht
Isomere einfach erklärt
Isomere sind chemische Verbindungen mit derselben Summenformel und Molekülmasse, aber unterschiedlicher Strukturformel. Sie unterscheiden sich also in der Verknüpfung ihrer Atome (Konstitutionsisomere/Strukturisomere) oder ihrer räumlichen Anordnung (Stereoisomere). Dadurch weisen sie meist verschiedene chemische oder physikalische Eigenschaften auf.
Einfach gesagt sind Isomere bestimmte Stoffe, die aus der gleichen Anzahl derselben Teilchen bestehen. Sie unterscheiden sich voneinander aber in der Struktur, also der Anordnung, der Teilchen.
Der Begriff Isomer stammt aus dem Griechischen und bedeutet so viel wie „gleiche Teile“ (von isos = gleich und meros = Anteil, Teil). Er bezeichnet zwei oder mehrere chemische Verbindungen mit gleicher Summenformel und Molekülmasse, jedoch einer unterschiedlichen räumlichen Anordnung und Verknüpfung.
Isomeriearten
Es werden verschiedene Arten von Isomeren (Isomeriearten) unterschieden, die sich in zwei Kategorien einteilen lassen: Die Konstitutionsisomere/Strukturisomere und die Stereoisomere.
Konstitutionsisomere sind chemische Verbindungen, die sich in ihrem molekularen Aufbau unterscheiden. Anders gesagt sind die Summenformeln zwar gleich, jedoch handelt es sich um komplett verschiedene Stoffe. Du unterscheidest sie weiter in:
- Funktionsisomere
- Skelettisomere
- Stellungsisomere
- Bindungsisomere
Stereoisomere haben dagegen dieselbe Struktur. Sie unterscheiden sich nur in ihrer räumlichen Anordnung. Ihre Unterschiede erkennst du also, wenn du sie im dreidimensionalen Raum betrachtest. Dabei werden zwei Untergruppen unterschieden:
- Konformationsisomere
- Konfigurationsisomere (Enantiomere, Diastereomere und Cis-Trans-Isomere)
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Konstitutionsisomere (Strukturisomere)
Konstitutionsisomere, auch Strukturisomere genannt, haben die gleiche Summenformel und unterscheiden sich lediglich in ihrem strukturellen Aufbau. Sie sind also unterschiedlich verknüpft.
Merke: Die Zahl der möglichen Konstitutionsisomere steigt mit der Anzahl der Atome in einer Verbindung.
Bei den Konstitutionsisomeren kannst du verschiedene Untergruppen unterscheiden:
-
Funktionsisomere: Hier unterscheiden sich die funktionellen Gruppen
der Moleküle durch die verschiedene Verknüpfung der Atome. Das beeinflusst auch die Eigenschaften und das Reaktionsverhalten der Verbindungen.
Beispiel: Ethanol und Dimethylether sind Funktionsisomere. Das Ethanol besitzt eine Hydroxygruppe (–OH) und das Dimethylether eine Ethergruppe (R1–O–R2).
-
Skelettisomere: Sie unterscheiden sich in ihrem Kohlenstoffgerüst.
Beispiel: Sie kommen meist bei organischen Stoffgruppen wie den Alkanen (z. B. Pentan = C5H12) vor.
-
Stellungsisomere: Hier befindet sich dieselbe funktionelle Gruppe an unterschiedlichen Stellen in der Verbindung.
Beispiel: Die Verbindungen 2-Amino-Butansäure, 3-Amino-Butansäure und 4-Amino-Butansäure (C4H9NO2) sind Isomere und besitzen alle eine Aminogruppe.
-
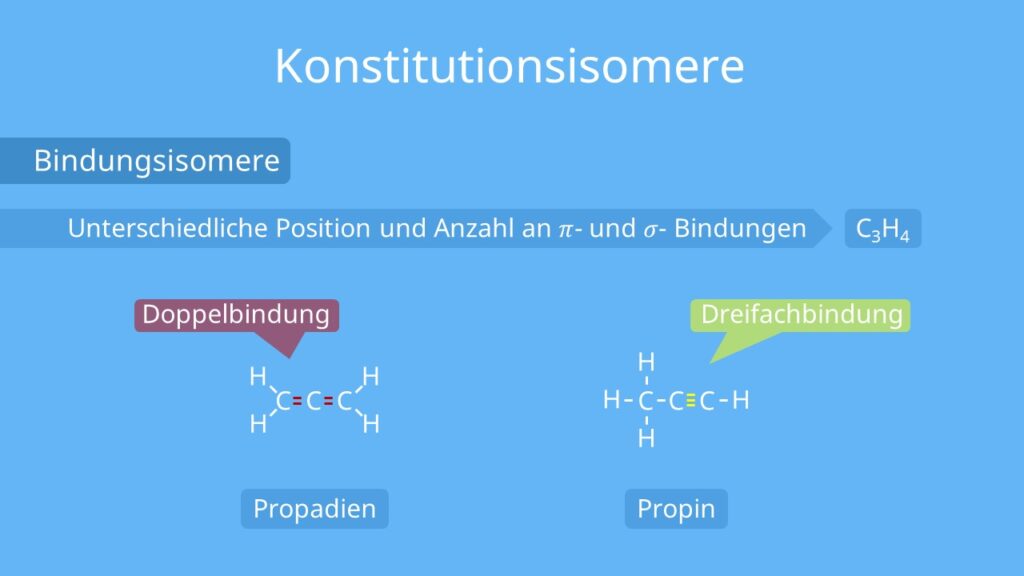
Bindungsisomere: Bindungsisomere unterscheiden sich in der Position und der Anzahl der Sigma- und Pi-Bindungen
.
Beispiel: Propadien und Propin (C3H4) sind solche Isomere. Propadien besitzt zwei Doppelbindungen, während Propin eine Dreifachbindung besitzt.
Insbesondere bei Alkanen findest du viele Konstitutionsisomerie. Dabei kannst du dir merken, dass Alkane mehr Isomere haben, je mehr C-Atome sie haben.
Während Butan (C4H10) nur zwei isomere Formen hat (n-Butan und 2-Methylpropan), besitzt Hexan (C6H14) bereits 5 (n-Hexan, 2-Methylpentan, 3-Methylpentan, 2,2-Dimethylbutan und 2,3-Dimethylbutan).
Stereoisomere
Stereoisomere sind chemische Verbindungen mit einer gleichen Summenformel und Struktur (Konstitution). Nur die Anordnung der Atome im dreidimensionalen Raum unterscheidet sich bei Stereoisomeren.
Du kannst sie noch weiter untergliedern, und zwar in Konformationsisomere und Konfigurationsisomere.
Konformationsisomere
Konformationsisomere (Konformere) sind die einfachere Form der Stereoisomere. Sie weichen nur durch eine Drehung, beziehungsweise Rotation, an einer C-C-Einfachbindung voneinander ab. Allerdings kannst du durch weitere Drehung zwei identische Moleküle erreichen.
Diese Rotation findet, in der Regel, durchgehend und mit einer hohen Geschwindigkeit statt. Du kannst die Konformationsisomere deshalb auch als Rotamere bezeichnen.
Ein Beispiel für ein Konformationsisomer ist das n-Hexan. Es macht dabei keinen Unterschied, welche der 5 C-C-Einfachbindungen rotiert wird — das Molekül bleibt das Gleiche.
Konfigurationsisomere
Konfigurationsisomere sind Stereoisomere — die Summenformel, Struktur und Verknüpfung der Atome ist also gleich. Sie unterscheiden sich lediglich in der räumlichen Struktur. Im Gegensatz zu den Konformationsisomeren sind sie jedoch nicht durch Drehung ineinander überführbar.
Du kannst die Konfigurationsisomere in drei größere Gruppen einteilen:
- Enantiomere (Spiegelbildisomere)
- Diastereomere
- Cis-Trans-Isomere
Enantiomere
Die Enantiomere sind Moleküle, die sich wie Spiegelbilder zueinander verhalten (Spiegelbildisomere). Diese Eigenschaft wird auch als Chiralität bezeichnet. Voraussetzung für ein Enantiomer ist, dass es mindestens ein Chiralitätszentrum (Stereozentrum) besitzt. Dabei handelt es sich um ein Kohlenstoffatom mit vier unterschiedlichen Substituenten.
Ein Beispiel für ein Enantiomer ist die Aminosäure Alanin. Sie hat die Summenformel C3H7NO2 und besitzt die zwei Enantiomere D-Alanin und L-Alanin. Sie verhalten sich wie Bild und Spiegelbild zueinander.
Schon gewusst? Die D, L-Nomenklatur, auch Fischer-Projektion genannt, wird vor allem bei Aminosäuren und Zuckern angewendet. Bei vielen anderen Substanzen stößt diese Nomenklatur jedoch an ihre Grenzen. Deshalb wurde für andere Stoffe die sogenannte R,S-Nomenklatur eingeführt.
Disastereomere
Die Diastereomere sind Stereoisomere, haben also dieselbe Konstitution, unterscheiden sich aber in der räumlichen Anordnung. Anders als bei den Enantiomeren verhalten sich Diastereomere nicht wie Bild und Spiegelbild. Als Voraussetzung für ein Diastereomer sind mindestens zwei Chiralitätszentren notwendig.
Ein Beispiel für Diastereomere sind die D-Glucose und die L-Galactose (C6H12O6). Du kannst die L-Galactose nämlich nicht so spiegeln, dass die D-Glucose entsteht.
Gut zu wissen: Die mögliche Anzahl an Diastereomeren einer Verbindung mit n-chiralen C-Atomen kannst du mit 2n bestimmen. Die D-Glucose und L-Galactose haben beispielsweise je vier Stereozentren, da an jedes der vier Kohlenstoffatome jeweils unterschiedliche Substituenten binden. Dadurch ergeben sich für die Glucose insgesamt 16 mögliche Diastereomere (24 = 16).
Cis-Trans-Isomere
Die Cis-Trans-Isomerie oder auch (Z)-(E)-Isomerie ist eine Art der Konfigurationsisomerie. Sie tritt entweder bei Molekülen mit Ringform oder mit Doppelbindungen auf. Hierbei sind die Substituenten um die Doppelbindung wichtig.
Zur Auffrischung: Unter einem Substituenten kannst du dir eine Atomgruppe vorstellen, die in einem Molekül das Wasserstoffatom ersetzt (substituiert).
Wenn die Substituenten in derselben Ebene liegen, sprichst du von einer cis- oder (Z)-Anordnung. Liegen sie hingegen in der entgegengesetzten Ebene, bezeichnest du das als trans- oder (E)-Anordnung.
Ein Beispiel für ein Molekül, bei dem die Cis-Trans-Isomerie vorkommt, ist Dichlorethen (C2H2Cl2).
Isomere — häufigste Fragen
-
Was ist Isomerie?
Isomerie bezieht sich auf das Vorhandensein von zwei oder mehr chemischen Verbindungen mit gleichen Summenformeln, jedoch unterschiedlicher räumlicher Anordnung oder Verknüpfung von Atomen. Diese Moleküle werden als Isomere bezeichnet. Grundsätzlich unterscheidest du zwischen Kostitutionsisomerie und Stereoisomerie.
-
Was ist Konfigurationsisomerie?
Konfigurationsisomere sind Stereoisomere, die sich in ihrer räumlichen Anordnung von Atomen und Atomgruppen unterscheiden, ohne dass Rotationen um Einfachbindungen berücksichtigt werden müssen, die nur zu unterschiedlichen Orientierungen führen. Beispiele für Unterschiede in der räumlichen Anordnung sind die Konfigurationen von Doppelbindungen, Ringverbindungen und chiralen Zentren.
-
Was ist Strukturisomerie?
Strukturisomere oder Konstitutionsisomere sind Moleküle, die sich in ihrer Zusammensetzung aus Atomen oder Atomgruppen unterscheiden, aber die gleiche Summenformel (Bruttoformel) haben. Ein Beispiel dafür sind n-Butan und iso-Butan. Auch verschiedene Tautomere eines Moleküls gehören zu den Strukturisomeren.
Chiralität
Wie du gesehen hast, gibt es viele verschiedene Arten von Isomeren. Für einige davon ist das Chiralitätszentrum von hoher Bedeutung. Schau dir als Nächstes unser Video zur Chiralität an, um zu erfahren, was ein Chiralitätszentrum ist und wie du es bestimmen kannst!