Halogenalkane
Halogenalkane können sehr giftig sein. Was die Eigenschaften von Halogenalkanen und deren typischen Reaktionen sind, erfährst du in diesem Beitrag.
Du möchtest das Thema in kürzester Zeit erklärt bekommen? Dann schau doch mal in unser Video rein.
Inhaltsübersicht
Halogenalkane einfach erklärt
Halogenalkane sind Alkane bei denen ein Wasserstoff durch ein Halogen ersetzt wurde. Die Halogene sind dabei Fluor, Chlor Brom oder Iod. Es können aber auch mehrere Wasserstoffatome durch Halogenatome ersetzt werden.
Die Nomenklatur der Halogenalkane funktioniert so wie du es auch schon bei den Cycloalkanen gelernt hast. Du nimmst einfach den Namen des Halogens und fügst den des Alkans hinten an. In diesem Fall: Bromethan.
Bei mehreren Halogenen im Molekül gehst du alphabetisch mit der Benennung vor. Das ist also ein 2-Chlor-1-Fluorpentan. Durch den Elektronegativitätsunterschied zwischen dem Kohlenstoff und dem Halogen liegt ein starkes Dipolmoment vor, das sich auf die physikalischen Eigenschaften und die Reaktivität der Stoffgruppe auswirkt.
Nukleophil
Kommen wir jetzt zu den unterschiedlichen Reaktionen von Halogenalkanen. Ein Halogenalkan wird typischerweise von einem Nukleophil angegriffen – zum Beispiel von Ethanolat, das formal aus Ethanol, also Alkohol entsteht.
Somit ist ein Nukleophil ein Reagenz mit bestimmten Eigenschaften. Es reagiert mit partiell positiven Stellen innerhalb eines Moleküls. Die Dreiecke zeigen dir in diesem Fall an, an welchem Atom die Elektrondichte höher ist. Außerdem muss ein Nukleophil ein freies Elektronenpaar besitzen. Dadurch ist es auch immer eine Base – wie du bereits aus der anorganischen Chemie weißt. Falls nicht, dann schau dir unser Video dazu an.
Es ergeben sich daher im Halogenalkan immer zwei Angriffspunkte. Bei einem positiv polarisierten a-Kohlenstoff und positiv polarisierten Wasserstoff am b-Kohlenstoff. Im Falle von Wasserstoff fungiert die Reagenz als Base und eliminiert dieses aus der Verbindung. Beim Kohlenstoff fungiert es als Nukleophil und substituiert das negativ polarisierte Halogenid.
Also gibt es zwei mögliche Reaktionen. Die Eliminierung und die Substitution, die beide jeweils als einstufiger und zweistufiger Mechanismus auftreten. Wir kommen damit auf insgesamt vier Reaktionsmöglichkeiten von Halogenalkanen: E1, E2, SN1 und SN2.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Eigenschaften Nukleophil
Bevor wir dir zeigen wie die Reaktionsmechanismen im Detail ablaufen, wenn ein Nukleophil ein Halogenalkan angreift, musst du erstmal entscheiden welcher der vier Mechanismen ablaufen wird. Dazu gibt es einige Eigenschaften bei beiden Molekülen, die du berücksichtigen musst.
Hartes und weiches Nukleophil
Ein Nukleophil kann hart oder weich sein.
Weiche Nukleophile haben große Ionenradien, eine geringe Ladungsdichte, sind gut polarisierbar und stehen eher links und unten im Periodensystem.
Harte Nukleophile haben kleine Ionenradien, eine hohe Ladungsdichte und sind schlecht polarisierbar. Sie stehen deshalb eher rechts und oben im Periodensystem. Du betrachtest hierbei nur das Atom mit dem freien Elektronenpaar. Sauerstoff im Ethanolat ist also eher ein hartes Nukleophil.
Starke und schwache Base
Des Weiteren musst du entscheiden ob das Nukleophil eher eine starke oder eine schwache Base ist. Dazu schaust du dir die korrespondierende Säure an. Beim Ethanolat ist das Ethanol. Dieses ist eher eine schwache Säure. Dann weißt du, dass Ethanolat eine starke Base sein muss.
Sterisch abgeschirmt und leicht zugänglich
Jetzt solltest du noch prüfen, ob das freie Elektronenpaar beim Nukleophil sterisch abgeschirmt oder leicht zugänglich ist. Beim Ethanolat ist es frei zugänglich, da es keine weiteren Bindungen am Sauerstoffatom behindern. Zum Vergleich ist bei einem 2-Methyl-2-propanol, oder auch tert-Butanol genannt, der Fall anders. Hier ist das freie Elektronenpaar durch die CH3-Fragmente sterisch abgeschirmter.
Substitutionsgrad
Als letztes betrachtest du noch den Substitutionsgrad vom Ca-Atom. Ist es hoch oder niedrig substituiert? Sollte es primär substituiert, hat es drei H-Atome und einen Alkylrest als Bindungspartner. Oder ist es sekundär, hat es zwei H-Atome und zwei Alkylreste, tertiär ein H-Atom und drei Alkylreste und quartär vier Alkylreste. Primär bis tertiär gilt als eher niedrig substituiert und quartär als eher hoch substituiert. Ethanolat ist sekundär, also eher niedrig substituiert.
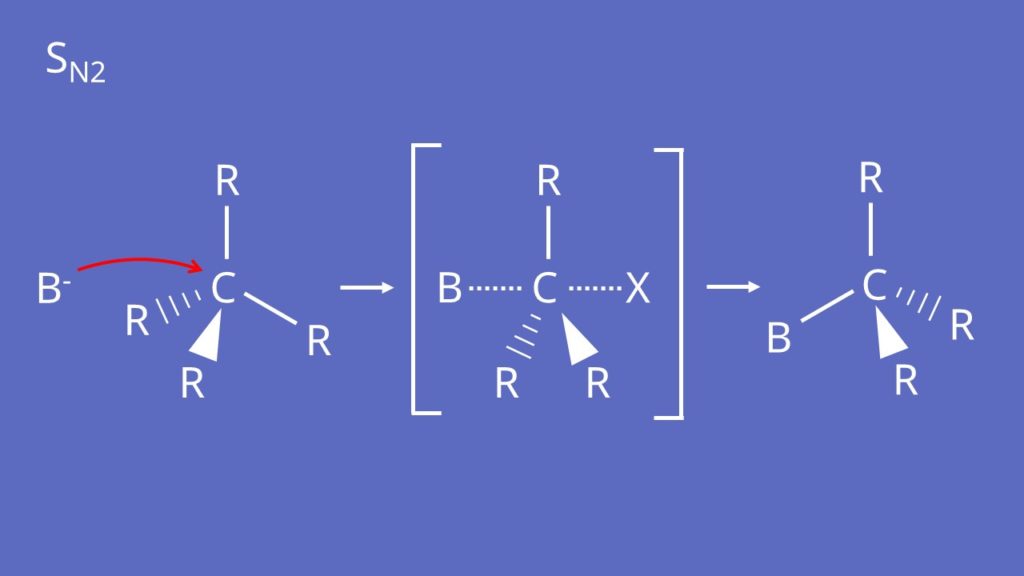
SN2-Mechanismus
Der SN2-Mechanismus läuft ab, wenn das Nukleophil ein weiches Teilchen ist und Ca niedrig substituiert ist.
Das Nukleophil greift das Halogenalkan von der Rückseite des Halogenids an. Hierbei bildet sich ein Übergangszustand, bei dem die Bindung des Nukleophils am Ca-Atom gleichzeitig mit dem Lösen des Halogenids abläuft. Man erhält ein Produkt, bei dem die Substituenten am Ca-Atom im Produkt inversiert sind.
Hier siehst du den Ablauf noch einmal anhand eines konkreten Beispiels mit 2-Brom-butan, das mit Natriumiodid reagiert.
Ein Iodanion ist ein eher weiches Teilchen, eine schwache Base und das freie Elektronenpaar ist nicht sterisch abgeschirmt. Das Ca-Atom ist sterisch eher gut zugänglich und wenig substituiert. Das bedeutet es läuft der SN2-Mechanismus ab. Nun greift das Iodanion von der Rückseite des Bromids an, substituiert dieses und wir erhalten 2-Iod-butan.
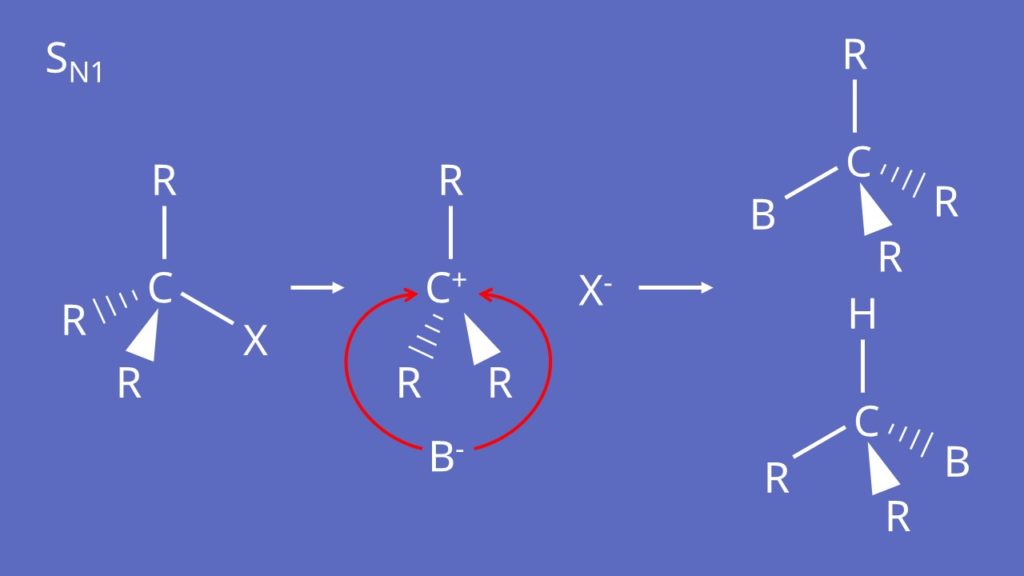
SN1-Mechanismus
Der SN1-Mechanismus läuft ab wenn das Nukleophil ein hartes Teilchen ist und Ca hoch substituiert ist. Zunächst tritt das Halogenid aus und es bildet sich im Zwischenschritt ein sogenanntes Carbokation. Dieses wird dann vom Nukleophil angegriffen. Da im Carbokation der Angriff von beiden Seiten gleich wahrscheinlich ist, bilden sich zwei Stereoisomere als Produkte. Im Video zur Chiralität erklären wir dir die Stereoisomere noch einmal genauer.
E2-Mechanismus
Ist Ca niedrig substituiert und das Lösemittel unpolar, dann verläuft die Eliminierung nach einem E2-Mechanismus. Anders als bei der Substitution greift hier das Nukleophil als Base am H-Atom an. Im Zwischenschritt wird das Wasserstoffatom vom Nukleophil abgespaltet und geht damit eine Bindung ein. Gleichzeitig löst sich das Halogenid aus dem Molekül. Es bildet sich zwischen den beiden C-Atomen eine Doppelbindung, um die fehlenden Bindungen der Atome zu kompensieren.
E1-Mechanismus
Du kannst es dir bestimmt schon denken. Ist das Lösemittel polar und das Ca-Atom hoch substituiert, dann verläuft die Eliminierung ähnlich wie die SN1-Reaktion und wird als E1 bezeichnet. Erst bildet sich wieder ein Carbokation, in dem sich das Halogenid vom Molekül trennt. Dadurch wird die Ca– Cβ-Bindung frei drehbar und es entstehen wieder zwei Stereoisomere als Produkt.