Carbonsäure
Carbonsäuren gehören zur organischen Chemie und können sehr sauer sein. In diesem Beitrag zeigen wir dir, wie die Stoffgruppe aufgebaut ist und was sie ausmacht.
Du möchtest das alles in einem kostenlosen Video kurz und knapp zusammengefasst bekommen? Dann schau in unser Video rein.
Inhaltsübersicht
Carbonsäure einfach erklärt
Carbonsäuren sind organische Stoffe, die mit einer oder mehreren Carboxylgruppe (-COOH) verbunden sind. Man kann die Carboxylgruppe daher auch als die funktionelle Gruppe der Carbonsäuren bezeichnen. In der Carboxylgruppe kann das Hydroxidion (-OH–) auch durch andere Atome ersetzt werden, wie zum Beispiel Chlor (Cl). Das führt dann zu den sogenannten Carbonsäurederivate, zu welchen Carbonsäureestern, Carbonsäureamide oder Carbonsäurehalogenide gehören.
Carbonsäure Strukturformel
Wie oben schon angedeutet besteht die Carbonsäure aus einem Rest (R) und der Carboxylgruppe (-COOH). Meistens handelt es sich bei dem Rest um eine Verbindung zwischen Wasserstoffen und Kohlenstoffen, weshalb auch von einer Alkylgruppe gesprochen werden kann. Die chemische Struktur des Restes ist dabei ausschlaggebend, ob es sich um eine aromatische, heterozyklische oder aliphatische Carbonsäure handelt. Aromatische Verbindungen besitzen ein Ringsystem, das nach der Hückel Regel aufgebaut ist. Aliphaten sind Bindungen, die zwar aus Kohlen- und Wasserstoffatomen zusammengesetzt sind, aber nicht aromatisch sind. Alkansäuren, Alkensäuren und Alkinsäuren wären Beispiele für die aliphatischen Carbonsäuren. Bei heterocyclischen Moleküle liegt ebenfalls eine Ringbildung, aber mit mindestens zwei verschiedenartigen Atomen vor.
Außerdem kannst du die Carbonsäuren noch in gesättigte und ungesättigte Säuren unterteilen. Bei den gesättigten Verbindungen hat der Kohlenstoff im Rest nur Einfachbindungen zu den jeweils anderen Atomen. Bei den ungesättigten liegen Doppel– oder Dreifachbindungen vor. Alkansäuren sind gesättigte, während Alkinsäure ungesättigte Verbindungen sind.
Die Strukturformel kannst du des Weiteren nach der Anzahl der Carboxylgruppen am Molekül unterteilen. Hier werden Monocarbonsäuren mit einer, Dicarbonsäure mit zwei und Tricarbonsäuren mit drei Carboxylgruppen unterschieden.
Weiterhin kann noch nach den funktionellen Gruppen unterschieden werden. Falls eine Carbonsäure mehrere unterschiedliche funktionelle Gruppen hat, so unterscheidet man in die Hydroxycarbonsäuren, Ketocarbonsäuren und die Aminosäuren. Bei den Hydroxycarbonsäuren liegt sowohl eine Carboxygruppe als auch eine Hydroxygruppe vor. Bei den Ketosäuren ist zusätzlich noch eine Ketogruppe vorhanden. Ein Keton hat ein Kohlenstoffatom (C) und ein doppelt gebundenes Sauerstoffatom (O). Bei den Aminosäuren gibt es zusätzlich noch eine Gruppe, die Stickstoff (N) enthält.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Vinyloge Carbonsäure
Unter dem Vinylogie Prinzip versteht man in der organischen Chemie, dass eine Verbindung bei der ein mesomere Effekt vorliegt, diesen auch beibehaltet, selbst wenn sie durch eine oder mehrere Doppelbindungen getrennt werden.
Dieses Prinzip tritt auch bei den Carbonsäuren auf, genauer gesagt bei dem Carboxylation. Das Anion der Carboxylatgruppe ist durch den mesomeren Effekt stabilisiert. Fügst du nun eine oder mehrere Doppelbindungen ein, wie das im unteren Bild der Fall ist, so bleibt die Mesomerie erhalten und das Molekül ist weiter durch den Effekt stabilisiert.
Alkansäuren
Alkansäuren sind die einfachste Form der Carbonsäuren. Sie bestehen aus einem Alkylrest und einer Carboxygruppe. Die allgemeine Summenformel lautet: CnH2n+1 Dabei steht n für eine beliebige Anzahl.
Die Alkansäuren zählen zudem zu den Monocarbonsäuren, da sie nur aus einer Carboxylgruppe bestehen.
Carbonsäure Eigenschaften
In dem Artikel zu den Carboxylgruppe erklären wir dir, wie die Abspaltung des Protons genau funktioniert. Auch den mesomeren Effekt, welcher für die Abspaltung maßgeblich verantwortlich ist, erläutern wir dir dort. Diese Zusammenhänge sind wichtig, da die Eigenschaften der Carbonsäuren ohne andere funktionelle Gruppen hauptsächlich durch die Carboxylgruppe bestimmt werden.
Außerdem ist die Carboxylgruppe verantwortlich für die Säurestärke der Carbonsäure. Je kürzer hier der Alkylrest ist, desto stärker wird auch die Säure. Ist der Rest allerdings länger so nimmt auch die Säurestärke ab, da der lange längere Alkylrest an der Carboxylgruppe die polare Wirkung aufhebt. Messbar kannst du das mit dem pKs-Wert machen.
Jedoch bestimmt die Alkylgruppe die physikalischen Eigenschaften der Verbindung, wie Siede- und Schmelztemperatur. Mit steigender Kettenlänge steigt nämlich die Siedetemperatur. Kurzkettige Reste haben hingegen relativ niedrige Siedepunkte und riechen stechend. Beispiele hierfür wäre die Ameisensäure oder die Buttersäure.
Die letzte Eigenschaft von Carbonsäuren ist, dass sie sehr gut Bindungen zwischen einander eingehen können. In der Carboxylgruppe liegt ein positiv geladenes Wasserstoffatom und ein negativ polarisiertes Sauerstoffatom vor, welche mit anderen Carboxylgruppen Wasserstoffbrückenbindungen ausbilden kann. Es bilden sich Dimere. Das ist ein Molekül, welches aus zwei identischen Einheiten, den Monomeren, besteht.
Reaktionen Carbonsäure
Generell kannst du sagen, dass Carbonsäuren sehr gut zugänglich für nucleophile Angriffe sind. Das liegt daran, dass das zentrale Kohlenstoffatom durch die benachbarten stark elektronenziehenden Sauerstoffatome eine positive Teilladung besitzt. Dieser nucleophile Angriff kann durch eine Säure katalysiert, das heißt gefördert werden.
In diesem Zusammenhang sind zwei wichtige Reaktionen an denen die Carbonsäuren beteiligt sind die Veresterung und die Dehydratisierung.
Bei der Veresterung reagiert die Carboxylgruppe mit der OH-Gruppe eines Alkohols. Dabei entsteht ein Ester und es findet eine Abspaltung von Wasser statt.
Der auf der rechten Seite entstehende Ester wird auch als Carbonsäureester bezeichnet. Außerdem kommt es gleichzeitig zur entsprechenden Rückreaktion. Das Wasser kann den Ester nucleophil angreifen. So kann wieder die ursprüngliche Säure gebildet werden.
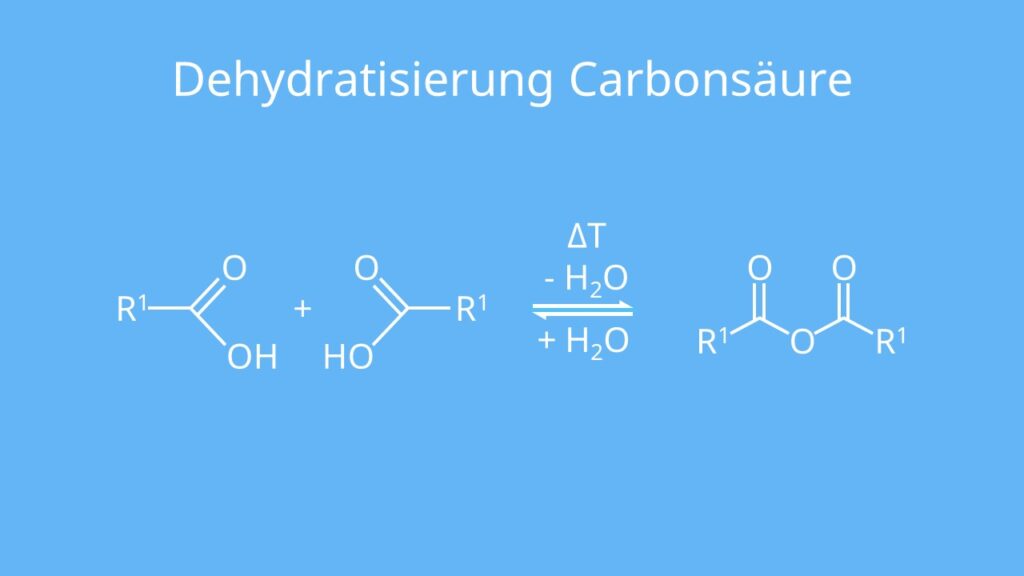
Ebenfalls können zwei Carbonsäuren unter intermolekularer Wasserabspaltung miteinander reagieren. Die Abspaltung von Wasser wird dabei als Dehydratisierung bezeichnet. Aus dieser Reaktion entsteht ein sogenanntes Carbonsäureanhydrid. Das sind Säuren, die einen Sauerstoff beinhalten.
Die Reaktion findet nur bei höheren Temperaturen statt.
Homologe Reihe der Carbonsäure
Die homologe Reihe bezeichnet eine Reihe von Stoffen, welche sich alle durch die selbe Summenformel darstellen lassen. Sie unterscheiden sich also nur in der Anzahl der Atome.
Die homologe Reihe der gesättigten Carbonsäuren wäre:
| Trivialname | Name | Formel |
| Ameisensäure | Methansäure | HCOOH |
| Essigsäure | Ethansäure | CH3COOH |
| Propionsäure | Propansäure | C2H5COOH |
| Buttersäure | Butansäure | C3H7COOH |
| Valeriansäure | Pentansäure | C4H9COOH |
| Capronsäure | Hexansäure | C5H11COOH |
| Önanthsäure | Heptansäure | C6H13COOH |
Spektroskopie der Carbonsäure
Die Grundlagen zur Spektroskopie sind hier verlinkt. Die gängigsten Verfahren, um die Struktur von Carbonsäuren herauszufinden sind die NMR– und die IR– Spektroskopie.