Atommasse
Was verstehst du unter der Atommasse? Was ist der Unterschied zwischen der relativen und der absoluten Atommasse? Das erklären wir dir in dem folgenden Beitrag.
Um das Thema noch schneller zu verstehen, kannst du dir gerne unser Video dazu anschauen!
Inhaltsübersicht
Atommasse einfach erklärt
Die Atommasse bezeichnet ganz einfach die Masse eines Atoms. Hierbei gibt es einerseits die relative und andererseits die absolute Atommasse.
Die Atommasse gibt dir die Masse eines Atoms an.
Du gibst die Atommasse meistens in der atomaren Masseneinheit  oder auch
oder auch  an. Auch die Angabe in
an. Auch die Angabe in  ist üblich.
ist üblich.
Atommasse u
Als erstes betrachten wir die Atommasse in  näher. Die atomare Masseneinheit
näher. Die atomare Masseneinheit
 hat den folgenden Wert in
hat den folgenden Wert in  :
:

Die atomare Masseneinheit in Kilogramm entspricht in etwa der Massen von Protonen und Neutronen
Der Grund dafür ist, dass die atomare Masseneinheit auch als ein Zwölftel der Masse des Kohlenstoffisotops 12C definiert ist. Das Kohlenstoffisotop 12C hat jeweils sechs Protonen und sechs Neutronen. Ein zwölftel der Masse des Kohlenstoffisotops 12C entspricht somit in etwa der Masse eines Kernteilchens.
Die atomare Masseneinheit hat einen großen Nutzen. Die Werte der atomaren Masseneinheit in  liegen stets nahe an ganzzahligen Werten, also der Massenzahl
. Meist beträgt die Abweichung weniger als
liegen stets nahe an ganzzahligen Werten, also der Massenzahl
. Meist beträgt die Abweichung weniger als  . Beispielsweise hat Fluor eine Atommasse von
. Beispielsweise hat Fluor eine Atommasse von  , was ganz nah an dem ganzzahligen Vielfachen Wert
, was ganz nah an dem ganzzahligen Vielfachen Wert  , also der jeweiligen Massenzahl liegt.
, also der jeweiligen Massenzahl liegt.
Die Abweichung der Atommasse vom ganzzahligen Vielfachen Wert hat mehrere Gründe. Zum einen besitzen Neutronen und Protonen nicht exakt die gleiche Masse. Zum anderen gibt es das Phänomen des Massendefekts .
Den größten Einfluss auf die Abweichung hat die Tatsache, dass viele Elemente in der Natur als Isotopengemische vorkommen. Somit sind die Atommassen der Elemente, die als Isotopengemische vorkommen, erst einmal von der prozentualen Zusammensetzung ihrer Isotope abhängig. Der dritte Grund ist das Phänomen des Massendefekts.
Möchtest du zum Massendefekt noch mehr erfahren, dann schau dir gerne unser Video zu diesem Thema an.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Relative Atommasse
Die relative Atommasse (auch Atomgewicht)  bezeichnet den Zahlenwert der Atommasse. Sie ist also einfach die atomare Masseneinheit ohne der Einheit
bezeichnet den Zahlenwert der Atommasse. Sie ist also einfach die atomare Masseneinheit ohne der Einheit  . Hierbei steht das Atomgewicht eines jeweiligen Elements im Periodensystem meist links unten, manchmal auch rechts oben.
. Hierbei steht das Atomgewicht eines jeweiligen Elements im Periodensystem meist links unten, manchmal auch rechts oben.
Das Element Helium hat in diesem Fall ein Atomgewicht von  .
.
Atommasse berechnen
Schauen wir uns zum Schluss die Formeln und Berechnungen zur Atommasse an, die du unbedingt brauchst.

Die Masse eines Atoms  setzt sich aus dem Zahlenwert der Atommasse
setzt sich aus dem Zahlenwert der Atommasse  und der Einheit
und der Einheit  zusammen.
zusammen.
Mittlere Atommasse berechnen
Jetzt zur mittleren Atommasse  . Der mittlere Atommasse ist hierbei auch eine relative Atommasse und kann deshalb auch als Atomgewicht bezeichnet werden. Da wie erwähnt Elemente oft als Isotopengemische vorkommen, liegt das Atomgewicht meist relativ weit weg von der Massenzahl eines Elements.
. Der mittlere Atommasse ist hierbei auch eine relative Atommasse und kann deshalb auch als Atomgewicht bezeichnet werden. Da wie erwähnt Elemente oft als Isotopengemische vorkommen, liegt das Atomgewicht meist relativ weit weg von der Massenzahl eines Elements.
Gucken wir uns mal an, wie du die mittlere Atommasse von Chlor berechnest. Chlor hat zwei Isotope, die in der Natur als stabile Form vorkommen. Das eine Isotop ist das  , das andere ist das
, das andere ist das  . Das
. Das  hat ein Atomgewicht von
hat ein Atomgewicht von  und kommt mit einer Häufigkeit von
und kommt mit einer Häufigkeit von  vor. Hingegen hat das
vor. Hingegen hat das  mit einer Häufigkeit von
mit einer Häufigkeit von  vor und hat ein Atomgewicht von 36,966\mathsf{u}.
vor und hat ein Atomgewicht von 36,966\mathsf{u}.
Nun bildest du nur noch das arithmetische Mittel beider Isotope.
![Rendered by QuickLaTeX.com \overline{m}_\mathsf{A} = m[^{35}\mathsf{Cl}] \cdot x + m[^{37}\mathsf{Cl}] \cdot y = 34,969 \mathsf{u} \cdot 0,7577 + 36,966 \mathsf{u} \cdot 0,2423} = 35,453 \mathsf{u}](https://blog.assets.studyflix.de/wp-content/ql-cache/quicklatex.com-f1697d155bc1212c3a03bb7816e4927b_l3.png)
Das Atomgewicht von Chlor beträgt also  . Vergleichst du den Wert mit einem aus dem Periodensystem
, so stimmen beide Werte sehr gut überein.
. Vergleichst du den Wert mit einem aus dem Periodensystem
, so stimmen beide Werte sehr gut überein.

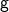 .
.