Enthalpie Definition
Die Enthalpie ist eine weitere thermodynamische Zustandsgröße. Was genau du mit ihr beschreiben kannst, lernst du in diesem Beitrag.
Inhaltsübersicht
Enthalpie berechnen
Im Wesentlichen ist die Enthalpie eine abstrakte Kenngröße für die Beschreibung eines thermodynamischen Systems. Als extensive Zustandsgröße von Materie beschreibt sie, wie viel Energie sich darin befindet. Sie ist damit die Summe der Enthalpien aller Teilsysteme.
Zur Erinnerung: Eine extensive Zustandsgröße ist eine Größe, die sich in Abhängigkeit der Größe des Systems ändert.
Die Enthalpie wird mit dem Buchstaben H bezeichnet und wurde früher auch Wärmeinhalt genannt. Sie ist die Summe aus der inneren Energie U des Systems und dem Produkt aus dem Volumen V und dem Druck p des Systems. Also:

Da die Dimension der Enthalpie die Energie ist, wird diese in der Einheit Joule gemessen.
Reaktionsenthalpie
Außerdem ist es nicht möglich die Enthalpie eines Zustands zu messen, sondern lediglich die Differenz zwischen zwei Zuständen. Also:

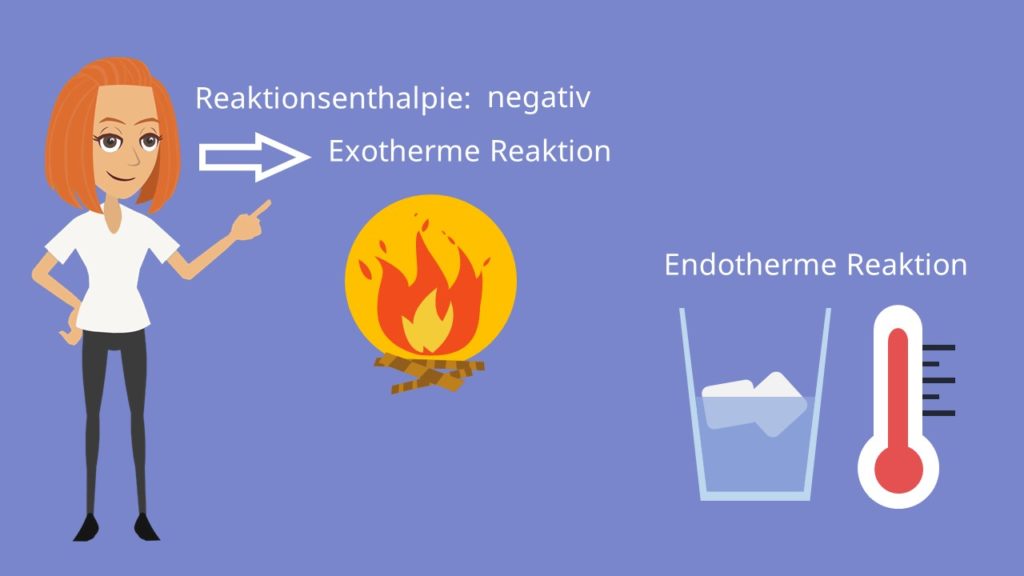
Diese Differenz bezeichnet man als Reaktionsenthalpie ΔH. Anhand der Reaktionsenthalpie kann man erkennen, ob ein Prozess exotherm oder endotherm abläuft.
Als kleines Beispiel schauen wir uns eine Verbrennung an. Die Reaktionsenthalpie bei der Verbrennung eines Stoffes an der Luft ist negativ. Es handelt sich also um eine exotherme Reaktion , bei der Wärme an die Umgebung abgegeben wird.
Beim Schmelzen von Eis dagegen, eine endotherme Reaktion , ist die Schmelz-Enthalpie jene Energie, die für die Änderung des Aggregatszustandes unter konstantem Druck benötigt wird. Die Energie wird der Umgebung entzogen und kühlt infolgedessen das Getränk.
Schau dir doch unser passendes Video an, wenn du mehr über exotherme und endotherme Reaktionen erfahren möchtest.
Begriffe wie „Enthalpieinhalt“ oder „Enthalpiezufuhr“ schaffen eine kompakte und anschauliche Beschreibung des Systems und seiner Prozesse. Häufig wird die Enthalpie zur Beschreibung isobarer Prozesse benutzt – also jener Prozesse, die unter konstantem Druck Δp = 0 ablaufen, sowie stationär strömender Fluide.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Molare und spezifische Enthalpie
Weiter unterscheidet man zwischen der molaren und der spezifischen Enthalpie.
Die molare Enthalpie bezieht sich auf die Stoffmenge und wird mit

in der Einheit Joule/mol beschrieben. H ist dabei die Enthalpie und n die Stoffmenge.
Die spezifischen Enthalpie h bezieht sich auf die Masse. Sie erhält man, wenn man die Enthalpie H durch die Masse m teilt:

Die spezifische Enthalpie wird in Joule/kg angegeben.
Sowohl die molare als auch die spezifische Enthalpie sind intensive Größen. Das bedeutet, dass sich diese bei unterschiedlicher Größe des betrachteten Systems nicht verändern.
Wenn zwei Teilsysteme die gleiche molare oder spezifische Enthalpie aufweisen, dann wird auch das von ihnen gebildete Gesamtsystem diese molare beziehungsweise spezifische Enthalpie aufweisen. Klingt logisch, oder?
Enthalpie und Bruttoenergie
Die durch einen Prozess bewirkte Veränderung der Enthalpie eines Systems

lässt sich als „Bruttoenergie“ bezeichnen. Also jene Energie, die bei einem isobaren Prozess dem System zugeführt werden muss, wenn dessen innere Energie um den Betrag  erhöht wird. Dabei verbraucht das System einen Teil der zugeführten Energie für die während des Prozesses zu leistende Volumenänderungsarbeit
erhöht wird. Dabei verbraucht das System einen Teil der zugeführten Energie für die während des Prozesses zu leistende Volumenänderungsarbeit  .
.
Für einen isobaren Prozess kann man also die benötigte Bruttoenergie  mit der zugeführten Enthalpie
mit der zugeführten Enthalpie  gleichsetzen und damit alle Vorteile des Rechnens mit Zustandsgrößen nutzen.
gleichsetzen und damit alle Vorteile des Rechnens mit Zustandsgrößen nutzen.
Sofern keine andere Arbeit als Volumenänderungsarbeit verrichtet wird, entspricht der Enthalpieumsatz des Prozesses dem Umsatz der Wärme.
Nun weißt du, was es mit der Enthalpie auf sich hat! Viel Erfolg!