p-V und T-S-Diagramm
In der Thermodynamik sind das p-V- und T-S-Diagramm wichtige Elemente, um Zustandsänderungen darstellen zu können. Wir schauen uns in diesem Beitrag an, was wir anhand dieser ablesen können.
Das p-V- und T-S-Diagramm sind spezielle Formen von Phasendiagrammen. Wir verwenden es, um Prozessabläufe zu veranschaulichen, wie zum Beispiel den Otto Prozess.
Inhaltsübersicht
p-V-Diagramm
Im Fall des p-V-Diagramms wird der Druck p eines Systems über das Volumen V aufgetragen.
Anstelle des Volumens V können wir auch das spezifische Volumen v verwenden. Das spezifische Volumen ist der Kehrwert der Dichte  . Dabei betrachtet man eine gleichbleibende Stoffmenge bzw. Masse.
. Dabei betrachtet man eine gleichbleibende Stoffmenge bzw. Masse.
Das Arbeitsdiagramm
Das p-V-Diagramm wird auch als Arbeitsdiagramm bezeichnet, da die Arbeit durch die Fläche unter der Kurve dargestellt wird.
In Kreisprozessen ist die gewonnene Arbeit also die von den Zustandskurven umschlossene Fläche. Die Volumenarbeit können wir folgendermaßen berechnen:

Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
T-S-Diagramm
Im T-S-Diagramm ist die Temperatur T über die Entropie S aufgetragen.
Die Entropie S kann auch durch die spezifische Entropie s ersetzt werden. Diese erhält man, wenn man die Entropie durch die Masse dividiert. Die Fläche unter den Kurven im T-S-Diagramm entspricht bei reversiblen Zustandsänderungen der, über die Systemgrenze zu- beziehungsweise abgeführten, Wärme. Bei einer Zustandsänderung von Zustand 1 nach 2 wird die folgende Wärmemenge zu- bzw. abgeführt:
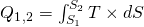
Wie bei der Arbeit entspricht die transportierte Wärme der Fläche zwischen der Zustandskurve, der Abszisse und den beiden Ordinaten.
Das ist auch schon alles, was du zu den Zustandsdiagrammen wissen muss. Fassen wir das nochmal kurz zusammen. Im p-V-Diagramm ist der Druck über das Volumen aufgetragen. Über die Volumenänderung kannst du die Arbeit berechnen. Im T-S-Diagramm ist die Temperatur über die Entropie aufgetragen. Über die Entropieänderung kannst du die Wärme berechnen.


